ГОМОЛОГІЧНИЙ РЯД АЛКЕНІВ
Алкени – вуглеводні, в молекулах яких є один подвійний зв`язок між атомами Карбону С=С. Алкени називають також олефінами, або етиленовими вуглеводнями.
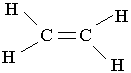 Етилен. Найпростішим алкеном є етилен С2Н4. За міжнародною номенклатурою назва етилену – етен. Структурна формула молекули етилену має такий вигляд:
Етилен. Найпростішим алкеном є етилен С2Н4. За міжнародною номенклатурою назва етилену – етен. Структурна формула молекули етилену має такий вигляд:
 Розглянемо природу зв’язків у молекулі С2Н4 з позицій сучасної електронної теорії. В атомі Карбону, який перебуває в збудженому стані (С* 1s22s12р3), гібридизації можуть зазнавати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві р-орбіталі. Третя р-орбіталь з неспареним електроном залишається в незмінному вигляді.
Розглянемо природу зв’язків у молекулі С2Н4 з позицій сучасної електронної теорії. В атомі Карбону, який перебуває в збудженому стані (С* 1s22s12р3), гібридизації можуть зазнавати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві р-орбіталі. Третя р-орбіталь з неспареним електроном залишається в незмінному вигляді.
Такий тип гібридизації (sр2-гібридизація) спостерігається при утворенні молекули етилену С2Н4.
Розміщення трьох гібридизованих sр2-орбіталей атома Карбону у просторі зображене на рис.5. Осі симетрії цих орбіталей лежать в одній площині і розміщені одна відносно одної під кутом 120°. Негібридизована р-орбіталь атома (на рисунку не показана) напрямлена перпендикулярно до площини гібридизованих орбіталей.
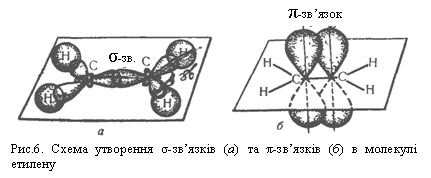
При утворенні молекули етилену гібридизовані орбіталі кожного атома Карбону перекриваються з двома s-орбіталями атомів Гідрогену і одна з одною. Електрони, що перебувають на цих орбіталях, утворюють σ-зв`язки (рис.6, а).
Під час зближення двох атомів Карбону відбувається також взаємодія негібридизованих р-орбіталей шляхом бічного їх перекривання, як зображено на рис.6, б. Зв`язок, утворений електронами, що перебувають на таких орбіталях, називається π-зв`язком.
Отже, подвійний зв`язок у молекулі етилену складається з одного σ- і одного π-зв`язків. Подвійний зв`язок міцніший від одинарного, але не в два рази. Зв`язки σ- і π- різняться за міцністю, більш стійкий σ-зв`язок. У структурних формулах σ- і π-зв`язки зображають однаково (рискою), проте слід пам`ятати про різну природу і міцність цих зв`язків.
Гомологи етилену. Етилен С2Н4 – перший член гомологічного ряду алкенів. Послідовно додаючи до формули гомологічну різницю СН2, можна одержати формули гомологів етилену: С3Н6, С4Н8, С5Н10 і т. Д. Загальна формула вуглеводнів ряду алкенів СnН2n , де n = 2, 3, 4 … .
Назви алкенів за міжнародною номенклатурою утворюють з назв алканів з такою самою кількістю вуглецевих атомів, замінюючи закінчення -ан на -ен, наприклад, етан С2Н6 – етен С2Н4, пропан С3Н8 – пропен С3Н6, бутан С4Н10 – бутен С4Н8.
Для найпростіших алкенів поширені також тривіальні назви, наприклад: етилен (етен), пропілен (пропен), бутилен (бутен).
Алкени утворюють радикали. Назва радикала складається з назви відповідного алкану і суфікса -іл; для радикалів найпростіших алкенів використовують тривіальні назви, наприклад:
СН2=СН– ; СН2=СН–СН2– .
Вініл (етеніл) Аліл (пропеніл)
Ізомерія. Для алкенів характерні два види ізомерії. Структурна ізомерія пов`язана з різним положенням подвійного зв`язку у вуглеводневому ланцюгу і з розгалуженням ланцюга. Наприклад, бутен має такі ізомери:
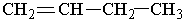 | 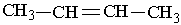 | ||||
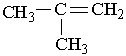 | |||||
Назви алкенів утворюють так. Вибирають найдовший вуглеводневий ланцюг, який містить подвійний зв`язок. Нумерують атоми Карбону в цьому ланцюгу, починаючи з того кінця, до якого ближче розміщений подвійний зв`язок. За основу (корінь) назви ізомера беруть назву алкену, що відповідає головному ланцюгу. Наприклад, бутен, якщо головний ланцюг містить 4 атоми Карбону, пентен – 5 атомів С, октен – 8 атомів С.
У назві алкену перед коренем зазначають бічні замісники (радикали), перед якими ставлять цифру, що вказує їх положення. Перед коренем записують номер вуглецевого атома (найменший), біля якого знаходиться 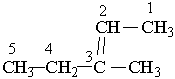 подвійний зв`язок. Отже, алкени в наведених нижче прикладах мають такі назви:
подвійний зв`язок. Отже, алкени в наведених нижче прикладах мають такі назви:
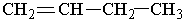 |
1-бутен 3-метил-2-пентен
Другий характерний вид ізомерії вуглеводнів з подвійним зв`язком – це просторова ізомерія, або стереоізомерія. Вона зумовлена різним положеннням замісників відносно площини, в якій розміщені подвій-; ні зв`язки. Для позначення стереоізомерів алкенів використовують префікси цис- і транс-. Наприклад, бутен-2 має такі стереоізомери:
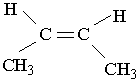 | |||
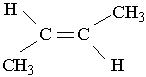 | |||
цис-2-бутен транс-2-бутен
У молекулі цис-ізомеру алкільні радикали розміщені по один бік від площини подвійного зв`язку, в молекулі транс-ізомеру – по різні боки. Перехід від цис-2-бутену до транс-2-бутену і навпаки можливий тільки під час розриву π-зв`язку між вуглецевими атомами.
Цис- і транс-ізомер різняться за властивостями. Наприклад, температура кипіння цис-2-бутену дорівнює 3,7°С, а транс-2 -бутену- +1°С.
ВЛАСТИВОСТІ, ДОБУВАННЯ І ЗАСТОСУВАННЯ АЛКЕНІВ
Властивості. Етен (етилен), пропен (пропілен) і бутени – безбарвні гази. Алкени нормальної будови від С5Н10 до С18Н36 – рідини, а починаючи з С19Н38 – тверді речовини.
Алкени мало розчинні у воді, густина їх менша від 1 г/см3.
На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено, наявністю в їхніх молекулах подвійного зв`язку. Алкени здатні вступати в реакції приєднання за рахунок розриву π-зв`язку. Крім того, π-зв`язок під дією окислювачів руйнується легше, ніж σ-зв`язок, тому для алкенів характерна участь у ролі відновників в окислювально-відновних реакціях.
1. Гідрування (приєднання водню). Приєднуючи водень, алкени переходять у алкани:
СН2=СН2 + Н2® СН3–СН3.
Реакції гідрування алкенів відбуваються при наявності каталізаторів (платини, паладію, нікелю).
2. Галогенування (приєднання галогенів). Алкени легко приєднують галогени, особливо хлор і бром:
СН2=СН2 + Вr2® СН2Вr–СН2Вr.
1,2-Диброметан
На цій реакції базується якісне визначення ненасичених сполук: бромна вода під час пропускання крізь неї етилену та інших алкенів знебарвлюється.
3. Гідрогалогенування (приєднання галогеноводнів). Галогеноводні також легко приєднуються до алкенів, наприклад:
СН2=СН2 + НВr ® СН3–СН2Вr.
Брометан
Ця реакція є гетеролітичною, що відбувається з утворенням іонів в результаті гетеролітичного розриву подвійного зв`язку. Подвійний зв`язок має підвищену електронну густину, тому він легко приєднує електрофільні ("ті, що люблять електрони") частинки. Молекула НВr може відщеплювати іон водню Н+, який виступає як електрофільна частинка. Іон водню взаємодіє з молекулою етилену, при цьому утворюється органічний катіон, який далі реагує з бромід-іонами.
Приєднання галогеноводнів до гомологів етилену може відбуватися двома шляхами, наприклад:
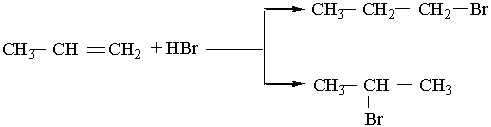
1-бромпропан
2-бромпропан
Під час цієї реакції утворюється переважно 2-бромпропан. Вивчення подібних реакцій дало змогу російському хіміку В.В.Марковникову сформулювати таке правило: атом водню галогеноводнів та інших несиметричних водневих сполук приєднується до найбільш гідрогенізованого атома вуглецю біля подвійного зв`язку (тобто до атома Карбону, який сполучений з великою кількістю атомів Гідрогену).
Правило Марковникова можна пояснити, враховуючи взаємний вплив атомів у молекулах алкенів. Електронегативність Карбону більша, ніж водню, тому на атомі Карбону радикала СН3 (у пропілені) утворюється підвищена електронна густина. У зв`язку з цим група СН3 буде електронодонорною, тобто вона буде подавати електрони (точніше, частину електронної густини). Подача або відтягування електронної густини під дією різних груп називається індуктивним ефектом.
Індуктивний ефект характерний для всіх алкільних радикалів. В результаті цього ефекту один атом Карбону біля подвійного зв`язку набуває часткового позитивного заряду, другий – часткового негативного заряду:
δ+ δ–
СН3®СН=СН2.
Стрілкою, напрямленою в бік зміщення електронної густини, позначають індуктивний ефект.
Під дією галогеноводню НВr іон водню Н+ приєднуватиметься до атома Карбону з негативним зарядом, а бромід-іон Вr– – до атома Карбону з позитивним зарядом. Тому в наведеній вище реакції переважно утворюється
2-бромпропан.
4. Гідратація (приєднання води). Під час гідратації алкенів при наявності каталізаторів (сірчаної кислоти чи інших) утворюються спирти; приєднання води до гомологів етилену відбувається згідно з правилом Марковникова, наприклад:
СН2=СН2 + Н2О ® СН3–СН2ОН;
Етиловий спирт
СН3–СН=СН2 + Н2О ® СН3–СНОН–СН3.
Ізопропіловий спирт
5. Полімеризація. Молекули алкенів можуть сполучатися одна з одною з утворенням макромолекул з розімкненням π-зв`язку. Реакції полімеризації алкенів далі розглянуто детально.
6. Окислення. Алкени легко окислюються, причому залежно від сили окислювачів реакції можуть відбуватися з розривом тільки π-зв`язку або з повним розривом подвійного зв`язку.
Перманганат калію в нейтральному і слабколужному середовищах окислює алкени з розімкненням π-зв`язку. Цю реакцію можна зобразити схемою:
СН2=СН2 + [О] + Н2О ® СН2ОН–СН2ОН.
Етиленгліколь
Якщо алкени пропускати крізь водний розчин перманганату калію, то відбуватиметься знебарвлення розчину. Цю реакцію, як і реакцію бромування, використовують для якісного визначення алкенів.
Сильні окислювачі (перманганат калію або дихромат калію при наявності сірчаної кислоти) окислюють алкени з розривом молекули за місцем подвійного зв`язку. В результаті утворюються різні кисневмісні органічні сполуки, наприклад:
К2Сr2О7, Н2SО4 |
СН3–СН=СН2 + [О] ––––––––® СН3–СООН + НСООН.
Під час високотемпературного окислення алкенів у кисні або на повітрі вони згоряють;
СН3=СН2 + 3О2® 2СО2 + 2Н2О.
В результаті завжди утворюються оксид Карбону (IV) і вода.
Добування. Лабораторним способом добування етилену та його гомологів є дегідратація (відщеплення води) спиртів при наявності концентрованої сірчаної кислоти чи інших водовідбирних агентів. Так, етилен можна добути з етилового спирту при нагріванні його з сірчаною кислотою:
Н2SО4 |
СН3–СН2ОН ––––®СН2=СН2 + Н2О.
Алкени можна добути з галогенопохідних алканів дією на них спиртового розчину лугу, наприклад:
СН3–СН2Сl + КОН® СН2=СН2 + КСl + Н2О.
Хлоретан
Відщеплення води та галогеноводнів (гідроген галогенідів) відбувається за правилом Зайцева: атом Гідрогену відщеплюється від сусіднього (до атому Карбону з функціональною групою) менш гідрогенізованого атома Карбону, наприклад:
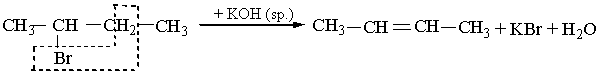 |
У промисловості алкени добувають з насичених вуглеводнів під час термічного розкладання (крекінгу) нафти, наприклад:
СН2=СН2 + СН4¬ СН3–СН2–СН3® СН3–СН=СН2 + Н2.
Етилен Метан Пропан Пропілен
|
СН3–СН3 –® СН2=СН2 + Н2.
Застосування. Етилен та інші алкени є важливою сировиною для хімічної промисловості. З етилену і пропілену виробляють пластмаси – поліетилен і поліпропілен. Етилен є вихідною речовиною для промислового добування багатьох органічних речовин.
Алкілуванням алкенів добувають насичені вуглеводні, які використовують як моторне паливо. Етилен прискорює достигання деяких плодів, для чого його вводять в атмосферу сховищ, де знаходяться недостиглі овочі та фрукти. Етилен також запобігає передчасному скиданню плодів рослинами в теплицях.
РЕАКЦІЇ ПОЛІМЕРИЗАЦІЇ АЛКЕНІВ
Полімеризація. Полімеризація – це процес послідовного сполучення молекул речовини в крупніші молекули. Речовина, що є вихідною в реакції полімеризації, називається мономером, продукт реакції – полімером, або високо-молекулярною сполукою.
У реакції полімеризації легко вступають ненасичені сполуки. При полімеризації етилену, наприклад, відбувається розрив π-зв`язків у молекулах під дією світла, випромінювання, хімічних речовин. Утворені частинки взаємодіють одна з одною:
СН2=СН2 + СН2=СН2 + СН2=СН2 +··· ®
® –СН2–СН2– + –СН2–СН2– + –СН2–СН2– +··· ®
® –СН2–СН2–СН2–СН2–СН2–СН2–··· .
В якийсь момент ріст молекули припиняється.
В результаті полімеризації етилену утворюється технічно важливий продукт – поліетилен (–СН2–СН2–)n , де n – ступінь полімеризації. Ступінь полімеризації показує, скільки елементарних ланок (у поліетилені елементарною ланкою є –СН2–СН2–) міститься в молекулі полімеру.
Для характеристики полімеру часто використовують поняття "молекулярна маса". В будь-якому зразку полімеру містяться молекули різної довжини і, отже, різної маси. Молекулярною масою полімеру вважають середню відносну молекулярну масу макромолекул цього полімеру. Цю величину можна визначити експериментально.
Залежно від таких факторів, як тиск, температура, наявність у системі різних речовин, одна й та сама речовина може полімеризуватися за радикальним і іонним механізмами.
Поліетилен. Реакцію полімеризації етилену було відкрито в 1933 р.
Властивості поліетилену залежать від молекулярної маси полімеру. Так, полімери з відносною молекулярною масою від 1000 До 10000 – це рідини, масла і воски. Ці полімери мають обмежене застосування. У наш час добувають переважно поліетилен з відносною молекулярною масою 50000 і вище. Такий поліетилен – це тверда біла речовина, тонкі плівки його майже прозорі. Поліетилен практично не розчиняється у воді та інших розчинниках (при кімнатній температурі). Має високу хімічну стійкість: руйнується лише під дією сильних окислювачів. Важлива властивість поліетилену – термопластичність: у нагрітому стані він розм`якшується, при цьому дуже легко можна змінювати його форму; при охолодженні він застигає і зберігає цю форму.
Існує два способи промислового добування поліетилену.
Поліетилен високого тиску добувають полімеризацією етилену під тиском від 120 до 300 МПа. В таких умовах реакція відбувається за радикальним механізмом. Як ініціатори використовують кисень або органічні пероксиди.
При полімеризації під високим тиском відбувається утворення розгалужених молекул поліетилену. Це можливо внаслідок переміщення неспареного електрона по ланцюгу полімеру.
Поліетилен низького тиску добувають полімеризацією етилену при наявності каталізаторів під атмосферним або дещо підвищеним (до 5 МПа) тиском. Як каталізатори використовують продукт взаємодії хлориду титану (IV) ТіСl4 з триетилалюмінієм Аl(С2Н5)3 або оксид хрому, нанесений на силікагель. В таких умовах полімеризація відбувається за іонним механізмом: каталізатор сприяє гетеролітичному розриву зв`язку в молекулі етилену. Відносна молекулярна маса поліетилену низького тиску, може досягати трьох мільйонів.
Поліетилен низького тиску відрізняється від поліетилену високого тиску меншою розгалуженістю ланцюгів і більшою густиною. Тому часто продукт, добутий при низькому тиску, називають поліетиленом високої густини, а полімер високого тиску – поліетиленом низької густини.
Промисловість випускає обидва види поліетилену – високого і низького тиску. Кожен з них має свої, притаманні йому корисні властивості. Так, поліетилен низького тиску більш міцний і твердий, поліетилен високого тиску відрізняється великою еластичністю і морозостійкістю. Поліетилен широко використовується в народному господарстві. З нього виготовляють плівку, труби, електроізоляційні матеріали, тару (бутелі, ящики), покриття, які захищають метали від корозії, волокна і нитки, деталі для машинобудування, предмети побуту.
Поліпропілен та інші поліалкени .
Полімеризацією пропілену СН3–СН=СН2 добувають інший важливий полімер – поліпропілен:
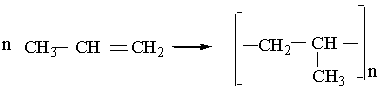 |
Поліпропілен – речовина молочно-білого кольору, один з найлегших полімерів, має високу твердість, міцність, стійкість проти стирання, термопластичність. Поліпропілен хімічно стійкий проти дії розчинників, кислот і лугів. Проте порівняно з поліетиленом він менш морозостійкий.
Поліпропілен широко використовується для виробницва міцних плівок, труб, електроізоляційних матеріалів, волокон, побутових виробів.
Крім поліетилену і поліпропілену в промисловості добувають інші поліалкени, наприклад:
полібутен-1 [–СН(С2Н5)–СН2–]n ,
поліізобутилен [–С(СН3)2–СН2–]n.
Співполімеризація. Співполімеризація – це процес утворення полімеру з двох, або більшої кількості різних мономерів. Під час співполімеризації двох мономерів А і В можливе утворення співполімерів різних типів:
регулярні співполімери:
··· –А–В–А–В–А–В–А–В– ···
··· –А–А–А–В–А–А–А–В– ···
нерегулярний співполімер:
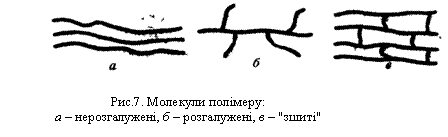
··· –А–А–В–А–В–А–В–В–А–А– ···
Співполімеризація використовується для добування матеріалів з заданими властивостями. Наприклад, здійснюючи співполімеризацію етилену з невеликими кількостями пропілену або бутилену-1, можна добути полімер з підвищеною еластичністю. Співполімер пропілену з невеликою кількістю етилену виявляє більшу морозостійкість, ніж чистий поліпропілен.