Класифікація і номенклатура неорганічних сполук
Речовини
| Прості (гомосполуки) складаються з атомів одного елемента | Складні (гетеросполуки) складаються з атомів різних елементів |
| метали, неметали, металоїди (перехідні елементи): 110 елементів, з них 88 металів і 22 неметали (діагональ від бору до астату). Цей поділ умовний, оскільки деякі елементи мають фізичні властивості металів, а хімічні – неметалів (Германій, Арсен, Стибій, Телур та ін.) – металоїди (напівметали). | За кількістю елементів поділяють на: - бінарні – 2 елемента; - тринарні – 3 елемента і т.д. За функціональними ознаками поділяють: - оксиди; - надпероксиди, пероксиди, озоніди; - основи; - амфотерні гідроксиди; - кислоти; - солі; - інші. |
| Прості речовини: Zn, Cu, P, S, Cl2, O2 | |
| Алотропні відозміни (різна кількість однакових атомів): S4, S8; O2, O3. | В складних речовинах атоми з’єднуються згідно їх валентності. Валентність – здатність атома утворювати певну кількість зв’язків з іншими атомами. Вища валентність дорівнює номеру групи, де міститься елемент; нижча=8 – вища валентність. |
| Різна будова кристалів: С – графіт, С – алмаз. |
Міжнародна номенклатура IUPAC
(Міжнародний союз теоретичної і прикладної хімії)
1. Хімічну формулу складної сполуки умовно поділяють на позитивно заряджену частинку (катіон) і негативну – аніон, позитивна частинка стоїть на першому місці.
Сa+2O-2 H2+SO4-2
2. Першим називають катіон, потім аніон – обидва у називному відмінку.
Якщо аніон складається з атомів одного елемента, то до його латинської назви додається суфікс –ід (-ид), якщо – з кількох, то суфікс –ат, вказується кількість і латинська назва елементів, в дужках можна вказувати валентність.
Числівникові префікси: 1 – моно; 2 – ди; 3 – три; 4 – тетра; 5 – пента;
6 – гекса; 7 – гепта; 8 – окта; 9 – нона.
CaO – кальцій оксид
H2SO4 – дигідроген тетраоксосульфат, гідроген сульфат (VI)
ICl3 – йод трихлорид, йод(ІІІ) хлорид
K2S – дикалій сульфід
K2Cr2O7 – дикалій гептаоксодихромат
Оксиди
Оксиди – це бінарні сполуки елементів з оксигеном:
- несолетворні (CO, NO, SiO);
- солетворні: основні, кислотні, амфотерні.
Одержання:
1. Взаємодія з киснем:
2 Cu + O2→(t°) 2 CuO
4 P + 5 O2→(t°) 2 P2O5
2 H2S + 3 O2→ (t°) 2 SO2 + 2 H2O
2. Розклад складних речовин:
2 Fe(OH)3→ (t°) Fe2O3 + 3 H2O
H2SO3→ (t°) SO2 + H2O
CaCO3→ (t°) CaO + CO2
Класифікація:
1. Основні оксиди – взаємодіють з кислотами з утворенням солей. Основним оксидам відповідають основи. Основні оксиди утворюють:
- метали з валентністю В=І: K2O, Cu2O, Ag2O.
- більшість металів з В=ІІ: CaO, FeO, CoO, MnO.
- деякі метали з В=ІІІ, IV: Tl2O3, Bi2O3, UO2.
K2O + H2SO4→ K2SO4 + H2O
FeO + 2 HCl → FeCl2 + H2O
Na2O + H2O → 2 NaOH (лужні, лужноземельні метали)
2. Кислотні оксиди – взаємодіють з лугами з утворенням солі і води, їм відповідають кислоти. Кислотні оксиди утворюють:
- неметали: SO2, P2O5, CO2, Cl2O7.
- метали з В=V, VI, VII: V2O5, WO3, Mn2O7.
SO2 (H2SO3) + NaOH → Na2SO3 + H2O
V2O5 (HVO3) + 2 KOH → 2 KVO3 + H2O
N2O3 + H2O →2 HNO2 (більшість кислотних оксидів)
3. Амфотерні оксиди – взаємодіють з кислотами і лугами з утворенням солі і води. Амфотерні оксиди утворюють:
- деякі метали з В=ІІ: ZnO, BeO, SnO, PbO, GeO.
- більшість металів з В=ІІІ, ІV: Al2O3, In2O3, Co2O3, SnO2, PbO2, MnO2.
- деякі метали з В=V, VI: Nb2O5, UO3.
Основні властивості:
Al2O3 + 3 H2SO4→ Al2(SO4)3 + 3 H2O
Кислотні властивості:
Сплавлення: Al2O3 (HAlO2) + 2 NaOH→2 NaAlO2 + H2O
Водний розчин: Al2O3 + 6 NaOH+ 3 H2O→2 Na3[Al(OH)6]
Взаємодія між оксидами з утворенням солей:
- основний + кислотний: CaO + SO3→ CaSO4
- основний + амфотерний: K2O + BeO → K2BeO2
- амфотерний + кислотний: BeO + N2O5→Be(NO3)2
Номенклатура:
Назви оксидів складаються з назви елемента у називному відмінку і слова „оксид” з використанням числівникових префіксів або вказуючи валентність елемента:
N2O5 – динітроген пентаоксид; нітроген (V) оксид
Гідроксиди (гідрати оксидів):
- основні (основи);
- амфотерні (амфоліти);
- кислотні (кислоти).
Основи
Основи – це сполуки, що містять негативно заряджену частинку (аніон) ОН- і катіон металу (NaOH, Cu(OH)2), катіон амоніаку (NH4OH) чи складну групу (ТіО2+: ТіО(ОН)2).
Основи | |
| Розчинні у воді (луги): NaOH, KOH, LiOH, Ca(OH)2, Ba(OH)2, Sr(OH)2, NH4OH. | Нерозчинні у воді: Mg(OH)2, Cu(OH)2, Fe(OH)2… |
Способи одержання | |
| Метал (оксид металу) + вода 2 Li + 2 H2O→2 LiOH + H2 Li2O + H2O → 2 LiOH | Сіль + луг FeCl2 + 2 NaOH →Fe(OH)2 + 2 NaCl CuSO4 + 2 KOH → Cu(OH)2 + K2SO4 |
Хімічні властивості | |
| Взаємодія з кислотними оксидами: 2 NaOH + SO3→ Na2SO4 + H2O NaOH→ (t°) – не розкладаються Змінюють забарвлення індикатора | Сu(OH)2 + SO3→не взаємодіють Розкладаються при нагріванні: Cu(OH)2→ (t°) CuO + H2O Не змінюють забарвлення індикаторів |
Спільні властивості – взаємодія з кислотами з утворенням солі і води: NaOH + HCl→NaCl + H2O Cu(OH)2 + 2 HCl→CuCl2 + 2 H2O | |
Номенклатура:
Назва елемента (його валентність) + слово „гідроксид”
Сu(OH)2 – купрум дигідроксид, купрум (ІІ) гідроксид.
Амфотерні гідроксиди
Амфотерним оксидам відповідають амфотерні гідроксиди (називаються як основи):
Zn(OH)2 – цинк гідроксид
Sn(OH)2 – станум (ІІ) гідроксид
Всі вони нерозчинні у воді, тому їх добувають за реакцією солі з лугом:
SnCl2 + 2 KOH→Sn(OH)2 + 2 KCl
Взаємодіють з кислотами і лугами:
Основні властивості: Sn(OH)2 + 2 HNO3→Sn(NO3)2 + 2 H2O
Кислотні властивості:
Сплавлення: Sn(OH)2 + 2 NaOH→Na2SnO2 + 2 H2O
У водному розчині: Sn(OH)2 + 2 NaOH→Na2[Sn(OH)4]
Кислоти
Кислоти – це сполуки, що містять гідроген-катіони, які здатні заміщуватися на метал і утворювати при цьому солі, і кислотний залишок.
За хімічним складом кислоти поділяють на:
- безоксигенові: HCl, HBr, H2S, HCN;
- звичайні оксигеновмісні – це гідрати кислотних оксидів: H2SO4 (SO3 + H2O), H3PO4 (P2O5 + H2O);
- полікислоти: H2Cr2O7, H4P2O7.
- тіокислоти – похідні звичайних оксигеновмісних кислот, в яких один або кілька атомів оксигену заміщені на атом сульфуру:
H2SO4→ H2SO3S → H2S2O3 - тіосульфатна кислота
- пероксокислоти: один або кілька атомів оксигену заміщені на пероксогрупу –О–О–:
H2SO4→H2SO5 - пероксосульфатна кислота
За основністю, яка визначається кількістю атомів гідрогену, здатних заміщуватися на метал, кислоти поділяють на:
- одноосновні: HCl, HNO3
- двоосновні: H2S, H2CO3
- триосновні: H3PO4, H3PO3
- чотирьохосновні: H4P2O7, H4SiO4
- п’ятиосновні: H5IO6
- шестиосновні: H6TeO6
Одержання кислот:
1. Кислотний оксид + вода:
CrO3 + H2O → H2CrO4
CO2 + H2O → H2CO3
2. Сіль більш слабкої кислоти + більш сильна кислота:
FeS + 2 HCl → FeCl2 + H2S
2 CH3COONa + H2SO4→2 CH3COOH + Na2SO4
Хімічні властивості кислот:
1. Всі кислоти реагують з речовинами основного характеру (основними і амфотерними оксидами, основами, амфотерними гідроксидами) з утворенням солей:
2 HCl + CuO→CuCl2 + H2O
2 HCl + ZnO→ZnCl2 + H2O
2 HNO3 + Mg(OH)2→ Mg(NO3)2 + 2 H2O
3 HNO3 + Al(OH)3→Al(NO3)3 + 3 H2O
2. Взаємодія металів з найбільш важливими кислотами:
А)Метали, що стоять в електрохімічному ряді напруг до Гідрогену витісняють водень Н2 з розчинів кислот: HCl, H2SO4(розв.), H2CO3, H3PO4 (крім HNO3 та конц. H2SO4):
Mg + H2SO4→MgSO4 + H2
Cu + H2SO4(розвед.) → не реагує
Б) Концентрована H2SO4 та HNO3(розведена та концентрована) реагують з металами, які стоять в ряду напруг від Li до Ag включно. Газ водень при цьому не виділяється!!!Ферум , Хром, Алюміній не реагують з концентрованою HNO3на холоду!!! (пасивація металу). Метали середньої активності та малоактивні метали реагують з цими кислотами за схемами:
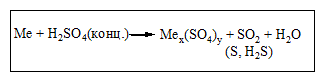
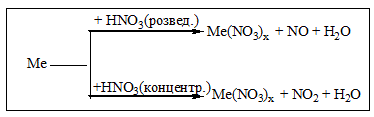
При взаємодії нітратної кислоти з металами можуть утворюватись іінші продукти відновлення Нітрогену(+5) :N2, N2O, NH4NO3.
Електрохімічний ряд напруг металів
| Li,Rb,K,Ca,Na,Mg,Be,Al,Ti,Mn,V,Zn,Cr,Fe,Ni,Sn,Pb,H,Bi,Cu,Hg,Ag,Pt,Au |
3. Кислоти реагують з солями більш слабких або летких кислот:
2 HCl + Na2CO3→2 NaCl + H2CO3 (CO2 + H2O)
Номенклатура кислот
Назви кислот утворюють від назви аніонів кислотних залишків з додаванням закінчення „на” та слова „кислота”.
1. Назви безоксигенових кислот.
Назва аніона (латинська назва елемента + суфікс –ід (-ид)) + закінчення „на” + слово „кислота”:
HCl – хлоридна кислота
H2S – сульфідна кислота.
2. Назви оксигеновмісних кислот.
2.1. Назва аніона (латинська назва елеманта + суфікс –ат) + закінчення „на” + слово „кислота”. В дужках вказується валентність кислотоутворюючого елемента. Якщо елемент знаходиться у вищому ступені окиснення, то його валентність і кількість атомів оксигену можна не вказувати:
H2Se+4O3 – селенатна (IV) кислота
H2Se+6O4 – селенатна (VІ) кислота, селенатна кислота
H2Mn+6O4 – манганатна (VI) кислота
HSb+5O3 – стибатна (V) кислота, стибатна кислота
2.2. Кислоти можна називати по назвах аніонів з використанням префіксів і суфіксів без вказування валентності.
Якщо елемент утворює кислоти в двох ступенях окиснення (+2, +4; +4, +6; +3, +5), то до назви елемента додають суфікс –ат (у вищому ступені окиснення) і –іт(-ит) (у другому ступені окиснення):
H2Se+4O3 – селенітна кислота
H2Se+6O4 – селенатна кислота
HSb+5O3 – стибатна кислота
HSb+3O2 – стибітна кислота
Якщо елемент утворює кислоти більше ніж в двох ступенях окиснення, то використовують префікси і суфікси (Cl, Br, I, Mn):
| Найменший пози-тивний ступінь окиснення гіпо- … -іт (-ит) | … -іт (-ит) | … -ат | Вищий ступінь окиснення пер- … -ат |
| +1 | +3 | +5 | +7 |
| HClO | HClO2 | HClO3 | HClO4 |
| гіпохлоритна | хлоритна | хлоратна | перхлоратна |
Якщо одному елементу з певним ступенем окиснення відповідають кілька кислот, то до назви додають префікс:
мета- для кислот з минимальним числом атомів гідрогену
орто- для кислот з максимальним числом атомів гідрогену.
НР+5О3 – метафосфатна кислота
Н3Р+5О4 – ортофосфатна кислота
Солі
Солі – це кристалічні речовини, що містять катіон металу або NH4 і кислотний залишок.
Найпоширеніший спосіб добування – реакція нейтралізації – взаємодія кислоти з основою:
кислота (Н+) + основа (ОН-) → сіль + вода
Класифікація:
1. Середні (нормальні) солі – утворюються при повному заміщенні атомів гідрогену в кислоті на метал (Na2SO4, K2CO3, CuS):
H2SO4 + Mg(OH)2→MgSO4 + 2 H2O
Назви середніх солей утворюють з назви катіона метала і аніона кислотного залишку у називному відмінку:
MgSO4 – магній сульфат
Fe(NO3)3 – ферум (ІІІ) нітрат
2. Кислі солі (гідрогенсолі) – утворюються при неповному заміщенні атомів гідрогену в кислоті на метал:
2 H2SO4 + Mg(OH)2→ Mg(HSO4)2 + 2 H2O
надлишок недостача
Назви утворюються з назви середньої солі з додаванням до назви аніона слова „гідроген”:
Mg(HSO4)2 – магній гідрогенсульфат
Ba(H2PO4)2 – барій дигідрогенортофосфат
3. Основні солі (гідроксосолі) – утворюються при неповному заміщенні ОН--груп в основі на кислотні залишки:
H2SO4 + 2 Mg(OH)2→(MgОН)2SO4 + 2 H2O
недостача надлишок
Назви утворюються з назви середньої солі з додаванням до назви катіона слова „гідроксо”:
(MgОН)2SO4 – гідроксомагній сульфат
Al(OH)2Cl – дигідроксоалюміній хлорид
Формули і назви кислот
| Формула кисло-ти (стара назва) | Назва кислоти | Назва кислотного залишку (аніона) |
| Сірчана H2SO4 | Дигідроген тетраоксосульфат Гідроген сульфат (VI) Сульфатна (VI) кислота Сульфатна кислота | Тетраоксосульфат Сульфат (VI) Сульфат |
| Сірчиста H2SO3 | Дигідроген триоксосульфат Гідроген сульфат (IV) Сульфатна (IV) кислота Сульфітна кислота | Триоксосульфат Сульфат (IV) Сульфіт |
| Сірководнева H2S | Дигідроген сульфід Сульфідна кислота | Сульфід |
| Тіосірчана H2S2O3 | Тіосульфат на кислота | Тіосульфат |
| Азотна HNO3 | Нітратна (V) кислота Нітратна кислота | Нітрат (V) Нітрат |
| Азотиста HNO2 | Нітратна (ІІІ) кислота (III) Нітритна кислота | Нітрат (III) Нітрит |
| Вугільна H2CO3 | Карбонатна кислота | Карбонат |
| Кремнієва H2SiO3 | Силікатна кислота | Силікат |
| Фосфорна, ортофосфорна H3PO4 | Ортофосфатна (V) кислота Ортофосфатна кислота | Ортофосфат (V) Ортофосфат |
| Метафосфорна HPO3 | Метафосфатна (V) кислота Метафосфатна кислота | Метафосфат (V) Метафосфат |
| Ортофосфориста H3PO3 | Ортофосфатна (III) кислота Ортофосфітна кислота | Ортофосфат (III) Ортофосфіт |
| Метафосфориста HPO2 | Метафосфатна (III) кислота Метафосфітна кислота | Метафосфат (III) Метафосфіт |
| Хлорна HClO4 | Хлоратна (VII) кислота Перхлоратна кислота | Хлорат (VII) Перхлорат |
| Хлорнувата HClO3 | Хлоратна (V) кислота Хлоратна кислота | Хлорат (V) Хлорат |
| Хлориста HClO2 | Хлоратна (III) кислота Хлоритна кислота | Хлорат (III) Хлорит |
| Хлорнуватиста HClO | Хлоратна (I) кислота Гіпохлоритна кислота | Хлорат (I) Гіпохлорит |
| Хлороводнева Соляна HCl | Гідроген хлорид Хлоридна кислота | Хлорид |
| Марганцева HMnO4 | Манганатна (VII) кислота Перманганатна кислота | Манганат (VII) Перманганат |
| H2MnO4 | Манганатна (VI) кислота Манганатна кислота | Манганат (VI) Манганат |
| Хромова H2CrO4 | Хроматна (VI) кислота Хроматна кислота | Хромат (VI) Хромат |
| Дихромова H2Cr2O7 | Дихроматна кислота | Дихромат |
| Оцтова СН3СООН | Ацетатна кислота Етанова кислота | Ацетат |
Технічні і побутові назви деяких речовин
Їдкий натр NaOH Мідний купорос CuSO4 · 5 H2O
Сода Na2CO3 Натрієва селітра NaNO3
Кристалічна сода Na2CO3 · 10 H2O Вапняк, крейда, мармур CaCO3
Питна сода NaHCO3 Простийсуперфосфат Ca(H2PO4)2+CaSO4
Кухонна сіль NaCl Подвійний суперфосфат Ca(H2PO4)2
Сірчистий ангідрид SO2 Доломіт CaCO3 + MgCO3
Кварц SiO2 Поташ K2CO3
Мінерал корунд Al2O3 (+Cr) – рубін, (+Ti) – сапфір
Гашене вапно Ca(OH)2 Малахіт (CaOH)2CO3
Негашене вапно CaO Рідке скло Na2SiO3
Плавікова кислота HF Азбест CaO · 3 MgO · 4 SiO2
Соляна кислота HCl Ціаністий калій KCN
Глауберова сіль Na2SO4 · 10 H2O Сурік Pb3O4 (Pb2PbO4)
Гірка сіль MgSO4 · 7 H2O Бура Na2B4O7 · 10 H2O
Гіпс CaSO4 · 2 H2O Алебастр 2 CaSO4 · H2O