Лабораторна робота № 2
"Окисно-відновні процеси"
І. ТЕОРЕТИЧНА ЧАСТИНА
Хімічний процес, який призводить до зміни ступенів окиснення атомів реагентів, називають окисно-відновним.
Ступінь окиснення – це умовний заряд атома, який визначається кількістю електронів, зміщених від менш електронегативного атома елемента до більш електронегативного атома. Атом елемента, від якого зміщено електрони, набуває позитивного значення ступеня окиснення. Атом елемента, до якого зміщено електрони, набуває негативного його значення.
При визначенні ступеней окиснення елементів користуються наступними основними правилами:
1) ступені окиснення елементів в простих речовинах дорівнюють нулю: 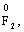
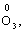
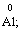
2) алгебраїчна сума ступенів окиснення усіх атомів молекули дорівнює нулю: Н2SO4: (2 ∙ 1 + 6 + 4 ∙(–2)) = 0;
3) сталий ступінь окиснення в сполуках виявляють
· елементи І групи головної підгрупи (+1): 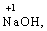
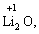
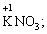
· елементи ІІ групи головної підгрупи, а також Цинк та Кадмій (+2):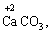
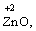
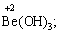
· Гідроген (+1):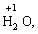
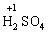 за винятком гідридів металів (–1):
за винятком гідридів металів (–1):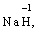
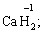
· Флуор (–1): 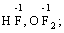
· Оксиген (–2): 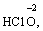
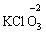 за винятком пероксидів (–1):
за винятком пероксидів (–1):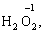
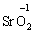 та оксиген флуориду (+2):
та оксиген флуориду (+2): 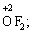
· Алюміній (+3): 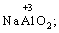
4) максимальний ступінь окиснення хімічних елементів (за винятком елементів І групи побічної підгрупи та VІІІ групи крім Os, Ru, Xe, а також Флуору і Оксигену) дорівнює номеру групи в періодичній системі: 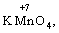
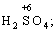
5) мінімальний ступінь окиснення металів дорівнює нулю: 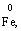
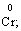
6) мінімальний ступінь окиснення неметалів дорівнює номеру групи періодичної системи, в якій знаходиться елемент, мінус число вісім: наприклад, для Сульфуру (VІ гр.) і Нітрогену (V гр.) мінімальні ступені окиснення відповідно дорівнюють 6 – 8 = –2 та 5 – 8 = –3: 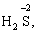
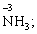
7) слід пам’ятати, що ступінь окиснення кислотоутворюючого елемента в кислоті та будь-якій її солі − однаковий: 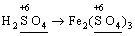
Окиснення – це процес, що супроводжується підвищенням ступеня окиснення елемента (віддавання електронів). Відновлення – це процес зниження ступеня окиснення (приєднання електронів).
Окисниками називають речовини, що містять елементи, атоми яких приймають електрони і при цьому відновлюються. До окисників відносяться: неметали (F2, O2), мінеральні кислоти, що містять кислотоутворювальні елементи у вищому ступені окиснення (HNO3, H2SO4), солі, що містять катіони у вищих ступенях окиснення (KMnO4, Fe2(SO4)3, K2Cr2O7) і ін.
Відновники – це речовини, що містять елементи, атоми яких віддають електрони і при цьому окиснюються. Відновні властивості характерні майже всім металам (Mg, Al), неметалам (S, C, P), сполукам, що містять метали або неметали у нижчому ступені окиснення (Na2S, NH3, CH4).
Речовини, що містять елементи у проміжному ступені окиснення, можуть проявляти окисно-відновну двоїстість, тобто бути і окисниками і відновниками (H2O2, SO2 та ін.).
Метод електронного балансу
При знаходженні стехіометричних коефіцієнтів окисно-відновних реакцій виходять з того, що кількість електронів, які віддає відновник, повинна дорівнювати кількості електронів, що приймає окисник. Складаючи рівняння окисно-відновних реакцій методом електронного балансу, дотримуються такої послідовності дій. Спочатку визначають ступені окиснення елементів, що входять в окисно-відновну реакцію, знаходять окисник і відновник.
Наприклад:
Mg0 + HN+5O3®Mg+2(NO3)2 + N+2O + H2O.
Ступені окиснення змінюють Магній і Нітроген, інші елементи не змінюють свої ступені окиснення. Далі складають рівняння електронного балансу, в яких число електронів, що приєднуються (віддаються), визначається за різницею між ступенями окиснення окисника (чи відновника) до реакції і після неї:
(відновник) Mg0 – 2 ē ®Mg+2 ½2 ½3 (окислюється)
(окисник) N+5 + 3 ē ®N+2½3 ½2 (відновлюється)
Кількість електронів, які віддає Магній Mg0, повинна дорівнювати кількості електронів, які приймає Нітроген N+5. Визначають найменше спільне кратне (6) та обчислюють коефіцієнти, ділячи найменше спільне кратне на кількість електронів у рівнянні окиснення і відновлення. Одержані цифри (3 і 2) і є реальними коефіцієнтами, які необхідно поставити перед Магнієм і Нітрогеном:
3 Mg + 2 HNO3®3 Mg(NO3)2 + 2 NO + H2O.
ОскількиНітрогенуправійчастинірівняннявходитьдоскладуоднієїсполуки (HNO3), авлівійчастині – доскладудвохсполук [Mg(NO3)2іNO], токоефіцієнтпередHNO3требазмінитина 8, щобурівнятикількістьатомівНітрогену. ПотімтребаурівнятикількістьатомівГідрогенуіОксигену. Повнерівняннязапишемотак:
3 Mg + 8 HNO3®3 Mg(NO3)2 + 2 NO + 4 H2O.
Приклад 2. На основі електронного балансу розставте коефіцієнти в рівнянні реакції:
КІ + КМnО4 + Н2SО4® І2 + МnSО4 + К2SО4 + Н2О
Розв’язання.
1) Виявляємо елементи, які змінюють ступінь окиснення:
до реакції 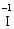 (в КІ),
(в КІ), 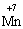 (в КМnО4);
(в КМnО4);
після реакції 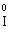 (в І2), Мn2+ (в МnSО4).
(в І2), Мn2+ (в МnSО4).
2) Складаємо електронні рівняння окиснення та відновлення:
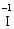 – ē®
– ē®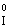
Коли в рівняннях реакцій після символу окисника або відновника стоїть індекс, наприклад, 2: (І2 або О2 тощо), застосовують правило подвоєння. Перед символом Іоду ставимо коефіцієнт два: 2І в правій та лівій частинах рівняння. Тоді кількість переданих електронів також подвоюється – два атоми Іоду віддають не один, а два електрони:
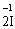 – 2ē®
– 2ē®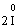
Це електронне рівняння можна записати і в такому вигляді:
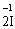 – 2ē®
– 2ē®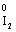 (1)
(1)
Запишемо електронне рівняння для Мангану:
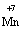 + 5ē® Мn2+
+ 5ē® Мn2+ (2)
(2)
3) Складаємо електронний баланс, на основі того, що кількість електронів, вивільнена у окисно-відновному процесі відновником, дорівнює кількості електронів, приєднаних окисником. Для цього знайдемо найменше спільне кратне чисел, які показують кількість відданих та приєднаних електронів (2 і 5), з електронних рівнянь. Це десять (10). Число 10 показує, скільки електронів віддає відновник і, відповідно, приєднує окисник. Щоб досягнути цієї рівності, домножуємо рівняння (1) на 5, а − на 2. Не слід забувати, що в електронних рівняннях сума зарядів та кількість атомів елементів повинна бути однаковою в обох частинах рівняння:

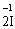 – 2ē®
– 2ē®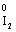 5
5
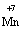 + 5ē® Мn2+ 2
+ 5ē® Мn2+ 2
4) Перед речовинами, котрі містять Манган, ставимо коефіцієнт 2 в обох частинах рівняння. З електронного рівняння реакції окиснення Іоду видно, що коефіцієнт 5 ставиться перед двома атомами Іоду (права частина рівняння). Отже, перед одними атомом Іоду (ліва частина рівняння) ставимо вдвічі більший коефіцієнт 2 ∙ 5 = 10:
10КІ + 2КМnО4 + Н2SО4® 5І2 + 2МnSО4 + К2SО4 + Н2О
5) Підбираємо коефіцієнти до інших членів рівняння у такому порядку: метали, кислотні залишки, йони Гідрогену:
10КІ + 2КМnО4 + 8Н2SО4 = 5І + 2МnSО4 + 6К2SО4 + 8Н2О
6) Щоб переконатись у правильності розставлених коефіцієнтів, порівняємо кількість атомів Оксигену в обох частинах рівняння: 40 = 40.
Типи окисно-відновних реакцій
Окисно-відновні процеси бувають − міжмолекулярного окиснення-відновлення, коли окисник і відновник належать до складу різних речовин:
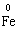 +
+ 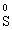 →
→ 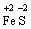
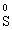 + 2ē →
+ 2ē →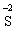 окисник (процес відновлення)
окисник (процес відновлення)
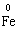 – 2ē → Fe2+ відновник (прцес окиснення)
– 2ē → Fe2+ відновник (прцес окиснення)
В цій реакції залізо є відновником, а сірка − окисником.
Реакції, в яких окисник і відновник входять до складу одної речовини, називаються − внутрішньомолекулярного окиснення-відновлення:
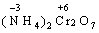 →
→ 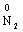 +
+ 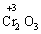 + 4Н2О
+ 4Н2О
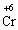 + 3ē →
+ 3ē →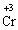 окисник (процес відновлення)
окисник (процес відновлення)
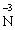 – 3ē →
– 3ē →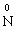 відновник (процес окиснення)
відновник (процес окиснення)
В цій реакції у складі молекули амоній дихромату Нітроген є відновником, а Хром − окисником.
Реакції, в яких той самий елемент і окиснюється, і відновлюється, називаються самоокиснення-самовідновлення (диспропорціювання). Щоб мати можливість диспропорціювання, елемент повинний перебувати у стані проміжного ступеня окиснення:
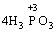 →
→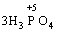 +
+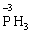
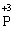 + 6ē →
+ 6ē → 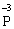 процес відновлення (окисник)
процес відновлення (окисник)
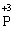 – 2ē →
– 2ē → 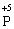 процес окиснення (відновник)
процес окиснення (відновник)
У цій реакції Фосфор має проміжний ступінь окиснення +3, отже він здатний віддати ще два електрони або приєднати ще шість електронів (окисно-відновна двоїстість). З рівняння реакції видно, що три з чотирьох молекул H3РО3 є відновниками, а одна молекула є окисником.