НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ)
Алкани є найпростішими вуглеводнями. Всі атоми Карбону в молекулах алканів сполучені один з одним простими, одинарними зв`язками. Алкани називають також парафінами, насиченими вуглеводнями.
ГОМОЛОГІЧНИЙ РЯД АЛКАНІВ
Метан. Найпростіший алкан – метан СН4, молекула якого складається з одного атома Карбону і чотирьох атомів Гідрогену.
 |
Як уже зазначалось, атом Карбону, що утворює чотири ковалентних зв`язки, знаходиться у збудженому стані (1s22s12р3). В утворенні чотирьох ковалентних зв`язків беруть участь одна s- і три р-орбіталі (рх, ру, рz) зовнішнього енергетичного рівня одного атома Карбону. Всі чотири ковалентних зв`язки, які утворює Карбон у молекулі СН4, рівноцінні: мають однакову довжину, енергію зв`язку та інші властивості.
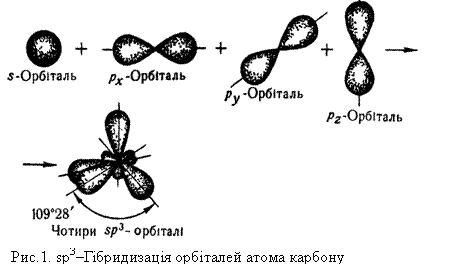
Рівноцінність хімічних зв`язків у метані можна пояснити, використовуючи поняття про гібридизацію орбіталей. Гібридизацією називається зміна форми і енергії різних орбіталей одного атома, яка приводить до утворення однакових (гібридизованих) орбіталей.
Наприклад, при утворенні молекули метану гібридизації зазнають орбіталі атома Карбону: одна s- і три р-орбіталі. Вид і число орбіталей, які беруть участь у гібридизації, визначають її тип. Так, у метані виявляється sр3-гібридизація. Рис.1 показує, як з однієї s- і трьох р-орбіталей утворюється чотири однакові гібридизовані sр3-орбіталі. У просторі ці орбіталі розміщені одна відносно одної під однаковими кутами і напрямлені до вершин тетраедра.
Під час утворення молекули метану СН4, sр3-гібридизовані орбіталі атома Карбону перекриваються з s-орбіталями атомів Гідрогену, що зображено на рис.2. Гібридизовані орбіталі атома Карбону напрямлені до вершин уявного тетраедра, що пояснює тетраедричну форму молекули метану.
Будову молекули метану можна зобразити також за допомогою кулестержневої моделі, показаної на рис.3, а. У цій моделі атоми умовно позначаються кулями, а хімічні зв`язки – стержнями, що сполучають кулі,
Гомологи метану. Крім метану всі інші вуглеводні, що належать до алканів, містять у складі молекули два, три і більше вуглецевих атомів:
СН4 — метан С8Н18 — октан
С2Н6 — етан С9Н20 — нонан
С3Н8 — пропан С10Н22 — декан
С4Н10 —бутан С11Н24 — ундекан
С5Н12 — пентан ……………………….
С6Н14 — гексан С20Н42 — ейкозан
С7Н16 — гептан ……………………….
Як видно з наведених формул, кожний наступний член цього ряду можна одержати, додаючи до формули попереднього члена групу СН2. Група СН2 називається гомологічною різницею. Речовини, подібні за хімічними властивостями, склад яких відрізняється на ціле число груп СН2, називаються гомологами. Сукупність гомологів складає гомологічний ряд.
Склад молекул усіх алканів відповідає загальній формулі СnН2n+2, де
n =1, 2, 3, 4… Отже, алкани – це вуглеводні, склад молекул яких відповідає загальній формулі СnН2n+2.
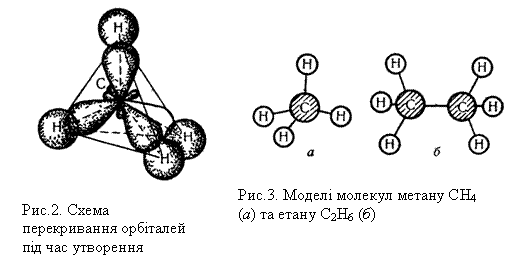 |
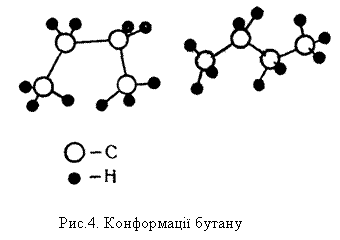
Будова молекул алканів, згідно з сучасними елетронними уявленнями про хімічний зв`язок, пояснюється так. У молекулах усіх алканів орбіталі атомів Карбону перебувають у стані sр3-гібридизації і напрямлені до вершин уявного тетраедра з їх центрів. Молекулу етану можна уявити як два тетраедри, сполучені вершинами. Кулестержнева модель молекули етану показана на рис.3, б. При такому сполученні групи СН3 можуть обертатися відносно зв`язку Карбон – Карбон, утворюючи різні геометричні форми – конформації.
Будову молекул решти алканів можна уявити як сполучення великої кількості тетраедрів. При цьому за рахунок вільного обертання груп навколо зв`язку С – С можливе утворення різних конформацій. На рис.4 показано дві з можливих конформацій бутану.
Ізомерія. Для алканів характерна структурна ізомерія, яка зумовлена можливістю розгалуження вуглецевого ланцюга молекули. Вуглеводень з прямим, нерозгалуженим ланцюгом називається нормальним ізомером. У алканах з розгалуженим, ланцюгом замісники (бічні ланцюги) можуть займати різне положення відносно головного ланцюга. Речовини, що мають однаковий склад, але різняться будовою вуглецевого ланцюга, називаються структурними ізомерами.
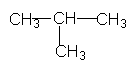
Першим членом гомологічного ряду алканів, який має ізомери, є бутан С4Н10. В одному з ізомерів С4Н10 всі атоми Карбону витягнуті в один ланцюг, у молекулі іншого ізомера головний вуглеводневий ланцюг складається з трьох атомів, а четвертий атом Карбону сполучений з середнім атомом ланцюга:
СН3–СН2–СН2–СН3,
Нормальний бутан
Ізобутан
Ізомери бутану різняться властивостями. Так, температура кипіння нормального бутану становить –0,5°С, а ізобутан кипить при температурі –11,7°С.
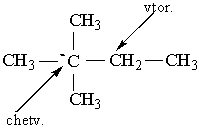
У іншого представника ряду алканів – гексану С6Н14 існує п`ять структурних ізомерів. Один з них н-гексан (нормальний гексан, буква н означає "нормальний") має прямий, нерозгалужений ланцюг, що складається з шести атомів Карбону, у двох ізомерів головний ланцюг містить п`ять атомів Карбону і, нарешті, можливі ще два ізомери, які мають у головному ланцюгу по чотири атоми Карбону:
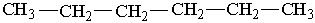 | ||||||||
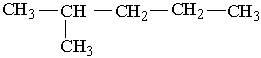 | ||||||||
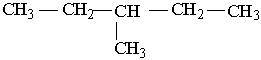 | ||||||||
 | ||||||||
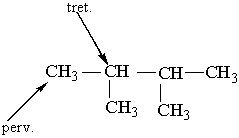 | ||||||||
Як можна бачити із структурних формул ізомерів, атоми Карбону можуть бути сполучені з різною кількістю інших атомів Карбону: одним, двома, трьома та чотирма. Залежно від цього розрізняють первинні (perv.), вторинні (vtor.), третинні (tret.) та четвертинні (chetv.) карбонові атоми.
Число ізомерів у алканів може бути різним. Воно зростає в міру збільшення числа атомів Карбону в молекулі алкану. Так, бутан має 2 ізомери, пентан – 3, гексан – 5, гептан – 9, октан – 18, нонан – 35, декан – 75 і т. Д. Ейкозан С20Н42 має вже 366319 ізомерів.
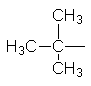
Вуглеводневі радикали. Якщо від молекули вуглеводню відщепити один або кілька атомів водню, то утвориться вуглеводневий радикал. Назви радикалів утворюють від назв відповідних алканів з заміною закінчення -ан на -ил
(-іл). Приклади вуглеводневих радикалів:
СН3– С2Н5– СН3–СН2–СН2– СН3–СН2–СН2–СН2–
Метил Етил н–Пропил н–Бутил
 | |||||||
 |  | ||||||
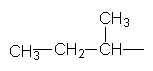 | |||||||
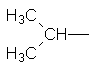
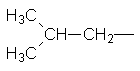
Ізопропил Ізобутил втор–Бутил трет–Бутил
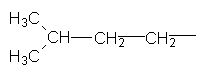 | |||
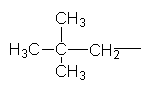 | |||
Ізопентил Неопентил
Як загальна назва вуглеводневих радикалів прийнятий термін "алкіл", їх позначають буквою R .
Номенклатура. Хімічна номенклатура — це система формул і назв хімічних речовин. Вона охоплює правила складання формул і назв. Для органічної хімії найбільш зручною є замісникова номенклатура, яка рекомендована ІUРАС (Міжнародна спілка теоретичної і прикладної хімії).
Для того щоб дати розгалуженому вуглеводню назву згідно з цією номенклатурою, необхідно виконувати такі правила.
Вибирають найдовший (головний) ланцюг атомів вуглецю в молекулі, нумерують атоми вуглецю в головному вуглеводневому ланцюгу, починаючи з того кінця, до якого ближче розміщені розгалуження (приклад а). Якщо замісники знаходяться на рівних віддалях від кінця ланцюга, то нумерацію починають з більш розгалуженого кінця (приклад b). Якщо розгалуженість головного ланцюга однакова, то нумерацію починають з того кінця, до якого ближче знаходиться радикал, назва якого стоїть раніше в алфавітному порядку (приклад c). Приклади:
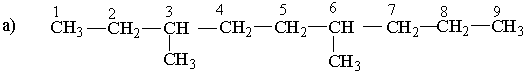 | ||||
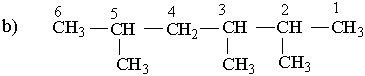 | ||||
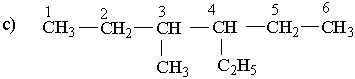 | ||||
За основу (корінь) назви розгалуженого вуглеводню беруть назву вуглеводню, що відповідає головному (пронумерованому) ланцюгу. Наприклад, якщо головний ланцюг містить 4 атоми Карбону, коренем буде "бутан", 9 атомів Карбону – корінь "нонан".
Назва розгалуженого вуглеводню будується в такій послідовності: спочатку зазначається цифра, що означає номер атома Карбону в головному ланцюгу, у якого є розгалуження (бічний ланцюг), потім назва радикала у бічному ланцюгу і назва найголовнішого ланцюга (корінь).
Якщо вуглеводень містить кілька однакових радикалів, то в його назві перелічуються цифри, що вказують їх положення, а число цих радикалів зазначається числовим префіксом: ди- (два), три- (три), тетра- (чотири), пента- (п`ять).
Різні за будовою радикали перелічують в алфавітному дорядку (за першою буквою в їх назві). Приклади:
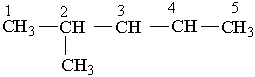 |
2-метилпентан
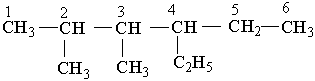 |
4-етил-2,3-диметилгексан
Для багатьох органічних речовин, у тому числі і для деяких алканів, зберігаються тривіальні назви, тобто назви, що склалися історично. Наприклад,
2-метилпропан має тривіальну назву ізобутан.
ВЛАСТИВОСТІ, ДОБУВАННЯ 1 ЗАСТОСУВАННЯ АЛКАН1В
Властивості. За звичайних умов метан, етан, пропан, ізомерні бутан і неопентан – безбарвні гази. Нормальні алкани, починаючи з вуглеводню С17Н36 (температура плавлення 22,5°С), за звичайних умов є твердими речовинами.
Усі алкани дуже мало розчинні у воді.
У хімічному відношенні алкани – інертні речовини, що визначається міцністю зв`язків Карбон – Карбон і Карбон – Гідроген. Крім того, ці зв`язки малополярні, тому для алканів будуть характерні реакції, що відбуваються з гемолітичним розривом зв`язків.
Реакції з участю алканів, як правило, ініціюються (викликаються) високою температурою, електромагнітним випромінюванням, прискорюються каталізаторами. Для алканів характерні такі реакції.
1. Галогенування (заміщення водню на галоген). Алкани можуть реагувати з хлором, бромом, якщо реакція ініціюється світлом.
Розглянемо як приклад хлорування метану. На світлі відбувається гемолітичний розрив молекул хлору з утворенням радикалів Сl·, і далі реакція відбувається за ланцюговим механізмом:
Сl2® 2Сl·
СН4 + Сl·®·СН3 + НСl
·СН3 + Сl2® СН3Сl + Сl· і т. Д.
Продуктами реакції можуть бути СН3Сl (метилхлорид, або хлорметан), СН2Сl2 (метиленхлорид, або дихлорметан), СНСl3 (хлороформ) і ССl4 (тетра-хлорид Карбону, або чотирихлористий вуглець). Кожний з названих продуктів можна виділити.
2. Нітрування (заміщення водню на нітрогрупу). Алкани вступають у реакцію з азотною кислотою при нагріванні, наприклад:
СН4 + НNО3® СН3NО2 + Н2О.
Ці реакції відкриті російським хіміком М.І.Коноваловим і дістали назву реакції Коновалова. Нітрування можна здійснювати не тільки азотною кислотою а й оксидами азоту (IV) NО2 або N2О4.
Реакції заміщення атомів Гідрогена на атоми галогенів, нітро-групу найлегше відбуваються біля третинного атому Карбону, що пояснюється найбільшою стійкістю третинних радикалів. Наприклад:
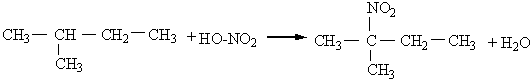 |
3. Окислення. Алкани згоряють на повітрі з виділенням великої кількості теплоти:
СН4 + 2О2® СО2 + 2Н2О; С3Н8 + 5О2® 3СО2 + 4Н2О.
На реакціях горіння алканів грунтується їх застосування як палива.
При невеликих температурах і наявності каталізаторів алкани можна окислити до органічних кислот.
4. Взаємодія з водяною парою. Важливе практичне значення має реакція метану з водою при високій температурі (800°С) – конверсія метану з водяною парою:
СН4 + Н2О ® СО + 3Н2.
Реакція відбувається при наявності каталізатора, її продуктом є синтез-газ – суміш оксиду Карбону (II) з воднем. Синтез-газ широко використовується в органічному синтезі.
5. Крекінг. Розщеплення молекул органічних сполук з розривом зв`язків Карбон – Карбон під дією високих температур називається крекінгом. Під час крекінгу алканів утворюються алкани з меншим числом атомів вуглецю і ненасичені сполуки (іноді водень), наприклад:
С4Н10® СН4 + С3Н6 або С4Н10® С2Н6 + С2Н4.
Добування. Промислові способи добування алканів грунтуються на виділенні їх з природних речовин, переважно нафти і природного газу.
Головною складовою частиною горючих природних газів і рудникового газу, який накопичується під землею (в шахтах, рудниках), є метан; його об`ємна частка може встановити до 98 %. З природних газів можна виділити також етан, пропан, бутан, ізобутан. Ці і більш тяжкі вуглеводні виділяють з нафти.
Метан та інші алкани утворюються під дією водню на вугілля при високій температурі:
С + 2Н2®СН4.
Такі реакції здійснюють на практиці при гідруванні вугілля (приєднання водню).
Суміш алканів можна добути при нагріванні суміші оксиду Карбону (II) з воднем над каталізатором:
nСО + (2n+1)Н2® СnН2n+2 + nН2О.
У лабораторних умовах метан можна добути, використовуючи такі реакції:
– розкладання карбіду алюмінію водою:
Аl4С3 + 12Н2О ® 3СН4 + 4Аl(ОН)3,
– сплавляння ацетату натрію з лугом [звичайно беруть натронне вапно – суміш NаОН і Са(ОН)2]:
СН3СООNа + NаОН ® СН4 + Nа2СО3
Інші алкани можна добути при дії металічного натрію на галогенопохідні вуглеводнів, наприклад:
2С2Н5Сl + 2Nа ® С4Н10 + 2NаСl
Реакції такого типу називаються реакцією В ю р ц а.
Застосування. Насичені вуглеводні широко використовуються в органічному синтезі. З них добувають багато органічних речовин: ненасичені вуглеводні, хлоропохідні, органічні кислоти.
Багато вуглеводнів входить до складу різних видів палива: горючого газу, бензину, гасу.
З вищих алканів виготовляють такі речовини, як парафін і вазелін, мастила, електроізолятори. Вищі алкани є сировиною для добування синтетичних мийних засобів.