АЛКІНИ
Алкіни – вуглеводні, в молекулах яких є два атоми Карбону, сполучені потрійним зв`язком –СºС–. Алкіни називають також ацетиленовими вуглеводнями.
Ацетилен С2Н2 та його гомологічний ряд. Найпростішим алкіном є ацетилен, або етин (за міжнародною номенклатурою):
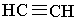 |

Розглянемо природу зв`язків у молекулі ацетилену згідно з електронною теорією. Під час утворення хімічних зв`язків у молекулі ацетилену гібридизації зазнають тільки дві орбіталі зовнішнього енергетичного рівня атома Карбону: одна s- і одна р-орбіталь. Цей тип гібридизації їазивається sр-гібридизацією. Дві р-орбіталі атома Карбону залишаються в незмінному вигляді. Розміщення двох гібридизованих орбіталей атома Карбону в просторі показано на рис.8: вони напрямлені вздовж однієї осі під кутом 180° одна до одної.
Гібридизовані орбіталі атомів Карбону перекривається одна з одною і з
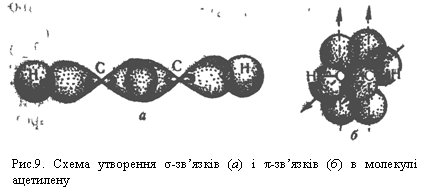
s-орбіталями атомів Гідрогену, що показано на рис.9, а. В результаті утворюються σ-зв`язки.
 |
Негібридизовані р-орбіталі атомів розміщені перпендикулярно до лінії
σ-зв`язку Карбон – Карбон і перпендикулярно один до одного. Ці р-орбіталі атомів вуглецю взаємодіють одна з одною за рахунок бічного перекривання. Електрони, що перебувають на цих орбіталяк, утворюють два π-зв`язки, напрямлені перпендикулярно один до одного, як показано на рис.9, б.
Отже, потрійний зв`язок у молекулі ацетилену складається з одного σ- і двох π-зв`язіків. Потрійний зв`язок міцніший, ніж подвійний, а відстань між атомами Карбону в ацетилені менша, ніж в етилені.
Ацетилен С2Н2 — перший член гомологічного ряду. Формули наступних алкінів одержують додаванням до формули ацетилеиу гомологічної різниці СН2: С3Н4, С4Н6 і т. Д.
Назви алкінів за міжнародною номенклатурою утворюють з назв алканів з тим самим числом атомів Карбону, замінюючи закінчення -ан на -ін (-ин). Приклади:
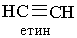 | 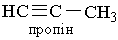 | ||
Назви алкінів з розгалуженим ланцюгом і структурних ізомерів алкінів, які утворюються внаслідок різного положення потрійного зв`язку в ланцюгу і бічних замісників, будують аналогічно до назв складних алкенів; цифра на початку назви означає найменший номер атома Карбону ланцюга, який знаходиться біля потрійного зв`язку.
Приклади:
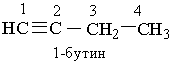 | 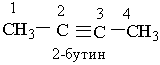 | ||
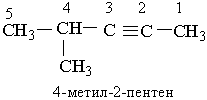
Загальна формула гомологічного ряду алкінів СnН2n–2, де n = 2, 3, 4, 5… .
Властивості. Ацетилен – це безбарвний газ без запаху, температура кипіння –83,8 °С. Розчинний у воді. Технічний ацетилен має неприємний запах, зумовлений наявністю домішок.
Як і алкени, ацетилен легко вступає в реакції приєднання і окислення. Крім, того, для алкінів характерні реакції заміщення водню, сполученого з атомом Карбону біля потрійного зв`язку.
1.Гідрування. Алкіни, приєднують водень при наявності каталізаторів з утворенням алканів або алкенів (неповне гідрування). Так, якщо як каталізатор застосовують нікель або платину, то при гідруванні ацетилену утворюється насичена сполука етан, а з каталізатором паладій або залізо – етилен:
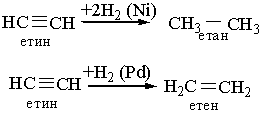
2. Галогенування. Алкіни легко приєднують хлор і бром. Реакція відбувається в дві стадії:
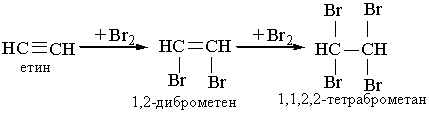
Як і етилен, ацетилен знебарвлює бромну воду. Ця реакція є якісною на ацетилен та інші алкіни.
3. Гідрогалогенування. Процес приєднання галогеноводнів до алкінів відбувається легко в дві розділимі стадії. На першій стадії утворюється галогенопохідна алкену, на другій до цієї похідної приєднується друга молекула галогеноводню згідно з правилом Марковникова:
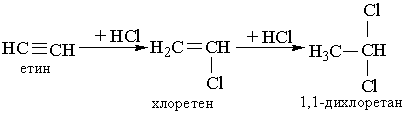
4. Гідратація. Ацетилен та його гомологи гідратуються при наявності каталізаторів – солей Гідраргіруму (II) НgSО4 або Нg(NО3)2. При гідратації ацетилену утворюється оцтовий альдегід:
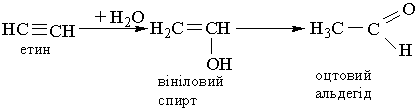
Взаємодія відбувається через стадію утворення нестійкої сполуки – вінілового спирту, який піддається ізомеризації в стійку сполуку – оцтовий альдегід. Цю реакцію відкрив російський вчений М.Г.Кучеров у 1881 р. Вона лежить в основі промислового добування оцтового альдегіду:
5. Окислення. Алкіни легко окислюються. Так, вони знебарвлюють розчин перманганату калію:
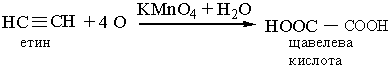
Цю реакцію використовують як якісну на потрійний зв`язок.
6. Реакції заміщення. Гідроген, сполучений, з атомом Карбону біля потрійного зв`язку, дуже рухливий, внаслідок чого для ацетилену та його гомологів характерні реакції заміщення. Наприклад, ацетилен та його гомологи, які містять потрійний зв`язок біля першого атома Карбону, взаємодіють з аміачними розчинами гідроксидів або солей Аргентуму і Купруму (І):
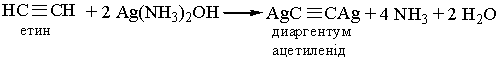 | |||
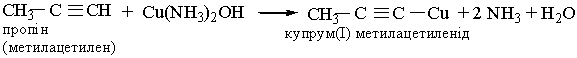 | |||
До похідних ацетилену – ацетиленідів металів – належить карбід кальцію СаС2, структура якого містить потрійні зв’язки Карбон – Карбон.
Добування. Для добування ацетилену в лабораторних умовах використовують реакцію карбіду кальцію з водою:
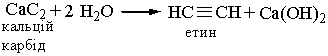
У промисловості ацетилен добувають з технічного карбіду кальцію або метану при нагріванні:
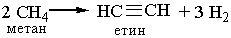
Гомологи ацетилену можна добути з дигалогенопохідних алканів, діючи на них спиртовим розчином лугу, наприклад:
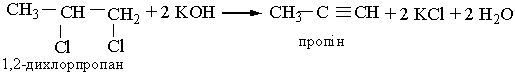 | |||
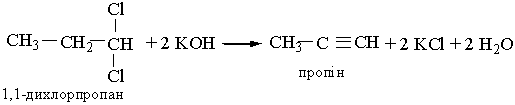 | |||
Застосування. Ацетилен є вихідною сировиною для багатьох органічних синтезів. У хімічній промисловості його застосовують для добування оцтового альдегіду і оцтової кислоти, вінілхлориду та інших речовин.
Ацетилен використовують для автогенного зварювання і різання металів, він згоряє в кисні, виділяючи велику кількість теплоти (температура полум`я досягає 3500 °С).