АРОМАТИЧНІ ВУГЛЕВОДНІ
Ароматичними вуглеводнями називаються сполуки, молекули яких містять стійкі циклічні структури – бензольні ядра. Термін "ароматичні сполуки" виник у початковий період розвитку органічної хімії, коли встановили, що речовини ряду бензолу виділяються з природних ароматичних речовин.
БЕНЗОЛ
Бензол є найпростішим ароматичним вуглеводнем. Його склад відповідає формулі С6Н6.
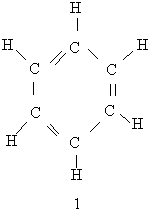
Будова молекули бензолу. Перша найбільш вдала структурна формула бензолу була запропонована в 1865 р. Німецьким хіміком Кекуле. Згідно з його уявленнями в молекулі бензолу чергуються подвійні і одинарні зв`язки між атомами Карбону, замкненими в шестичленний цикл (див. Формулу 1). Ця формула показує рівноцінність усіх атомів Карбону і Гідрогену, які входять в молекулу бензолу, що було доведено експериментально. Використовуючи формулу 1, слід враховувати, шо бензол не можна відносити до звичайних ненасичених сполук, оскільки він значно відрізняється від них за властивостями, наприклад, не приєднує бром.
 |  | 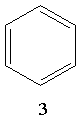 | |||
Для позначення бензолу прийнято також формулу 2 і спрощену формулу Кекуле 3. Остання формула використовуватиметься при подальшому викладенні матеріалу:
Згідно з сучасними електронними уявленнями будова молекули бензолу пояснюється так. У цій молекулі орбіталі зовнішнього енергетичного рівня кожного атома Карбону перебувають у стані sр2-гібридизації. Електрони, що перебувають на гібридизованих орбіталях, утворюють σ-зв`язки між сусідніми атомами вуглецю і σ-зв`язки Карбон – Гідроген, як показано на рис.11.
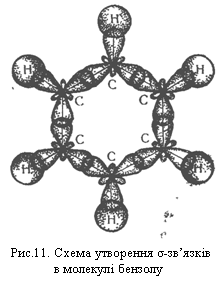
sр2-Гібридизовані орбіталі розміщуються під кутом 120° одна до одної, тому в молекулі бензолу атоми Карбону розміщуються в кутах правильного шестикутника.
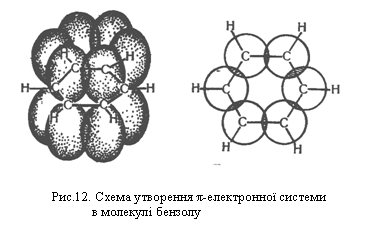
р-Орбіталі шести атомів Карбону в бензолі, які не беруть участі в гібридизації, розміщуються перпендикулярно до площини бензольного кільця і перекриваються одна з одною зверху і знизу цієї площини. Електрони, що перебувають на цих орбіталях, утворюють єдину стійку π-електронну систему, показану на рис.12. Так виникає хімічний зв`язок, який об`єднує всі шість атомів Карбону в молекулі бензолу.
 |
Молекула С6Н6 плоска, всі атоми Карбону розміщені на однакових віддалях один від одного, утворюючи пра вильний шестикутник.
Властивості. Бензол – безбарвна рідина, що має характерний запах. Легко переходить у твердий стан: температура плавлення бензолу становить +5,5°С, температура кипіння +80,1°С. У воді бензол практично не розчиняється, але є хорошим розчинником багатьох органічних речовин.
Хімічні властивості бензолу та інших ароматичних сполук характеризуються рядом особливостей.
Для бензолу характерні реакції заміщення атомів водню в бензольному кільці. Ці реакції відбуваються за механізмом електрофільного заміщення.
На відміну від ненасичених сполук типу алкенів і алкінів, бензол дуже стійкий проти окислення, важко вступає в реакції приєднання. Розглянемо найбільш характерні для ароматичних вуглеводнів реакції.
1. Нітрування. При дії на бензол нітруючої суміші (суміш концентрированих азотної і сірчаної кислот) відбуваться заміщення Гідрогену в ядрі бензолу на групу NО2 з утворенням нітробензолу; цей йроцес називається нітруванням:
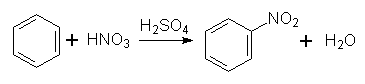
Реакція відбувається за механізмом електрофільного заміщення. Роль електрофільної частинки відіграє іон NО2+, який утворюється в результаті реакції:
НNО3 + Н2SО4 ↔ NО2+ + Н2О + НSО4–.
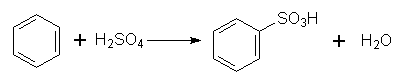
2. Сульфування. Гідроген в бензольному ядрі може бути заміщений на сульфогрупу SО3Н під дією концентрованої сірчаної кислоти з утворенням бензолсульфокислоти; цей процес називається сульфуванням:
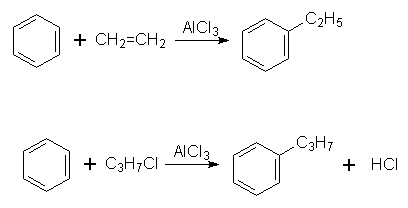
3. Алкілування. В молекулу бензолу замість Гідрогену можна ввести алкільний радикал. Процес алкілування можна здійснити дією на бензол галогенопохідної алкану чи олефіну при наявності каталізатора (алюміній хлорид АlСl3):
4. Галогенування. Заміщення Гідрогену в бензольному ядрі на Хлор чи Бром здійснюється при взаємодії бензолу з галогенами за участю каталізатора. Реакцію можуть каталізувати FеСl3 (або FеВr3) і АlСl3, при цьому утворюються різні продукти:
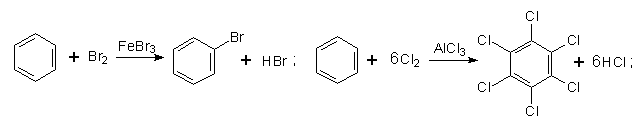
Під час інтенсивного опромінення реакційної системи світлом бензол може приєднувати хлор з утворенням гексахлорциклогексану (гексахлорану):
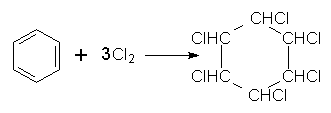
На відміну від наведених вище реакцій галогенування, в яких атом Хлору чи Брому заміщує Гідроген в бензольному ядрі, в цій реакції атоми Хлору приєднуються до всіх атомів Карбону. В результаті руйнується π-електронна система бензолу і утворюється галогенопохідна циклоалкану.
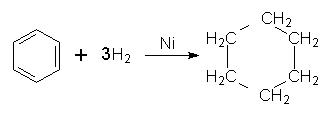 |
5. Гідрування. Одна з небагатьох реакцій приєднання, в яку може вступати бензол, – реакція гідрування (приєднання атомів Гідрогену) при наявності платинових або нікелевих каталізаторів з утворенням циклогексану:
Добування. Бензол виділяють переважно з нафти та кам`яного вугілля при виробництві коксу.
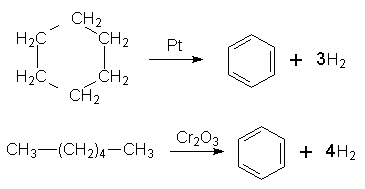 |
Бензол можна здобути з циклогексану за реакцією дегідрування з участю платини (нікелю) як каталізатора або шляхом циклізації і дегідрування нормального гексану при наявності Сr2О3:
Застосування. Бензол є важливою сировиною для органічного синтезу, його використовують при добуванні багатьох інших ароматичних сполук. Бензол застосовують у виробництві барвників, пластмас, пестицидів, вибухових речовин, ліків; його використовують як розчинник лаків, фарб.
Бензол входить до складу палива, яке використовується в двигунах внутрішнього згоряння.
ГОМОЛОГИ БЕНЗОЛУ
Гомологи бензолу – це ароматичні вуглеводні, в бензольному кільці яких один чи декілька атомів Гідрогену заміщені на алкільні радикали.
Загальна формула сполук гомологічного ряду бензолу СnН2n–6, де
n = 6,7,8,9… .
Найпростішим гомологом бензолу, який відрізняється від нього на одну групу СН2, є метилбензол, або толуол, С6Н5–СН3.
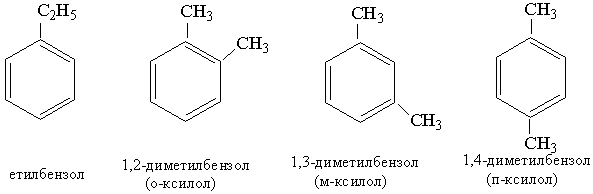 |
Ізомерія та номенклатура. Наступний за толуолом гомолог бензолу має склад С8Н10, якому відповідають чотири сполуки:
Як видно з наведених формул, гомологи бензолу, що мають у ядрі два однакових замісники, розрізняються розміщенням цих замісників один відносно одного, тобто є ізомерами. .
Назви гомологів бензолу складаються з назви замісника (алкілу) з додаванням кореня бензол, наприклад етилбензол. Якщо гомолог містить кілька замісників, то їхнє положення зазначають цифрами, що означають номери атомів Карбону в бензольному ядрі, біля яких знаходяться ці замісники, наприклад 1,2-диметилбензол. Нумерацію починають з одного з атомів вуглецю, біля якого є замісник.
Для багатьох гомологів широко використовуються тривіальні назви (толуол, ксилол),
Для позначення ізомерів з двома однаковими замісниками використовують префікси: орто-, мета-, пара-. В орто-ізомері замісники мають положення 1,2, в мета-ізомері – положення 1,3 і в пара-ізомері – положення 1,4.
Ароматичні вуглеводні утворюють радикали, які є складовими частинами складніших сполук, наприклад:
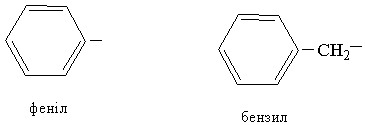 |
Загальна назва радикалів ароматичних вуглеводнів – арил.
Властивості. Найпростіші гомологи бензолу за звичайних умов – це рідини з характерним запахом, вищі гомологи – тверді речовини. Для гомологів бензолу характерні ті самі реакції, що й для самого бензолу.
1. Нітрування, сульфування, та алкілування. Ці реакції відбуваються, як і для бензолу, за механізмом електрофільного заміщення.
Особливість перебігу цих реакцій для гомологів бензолу виявляється в тому, що замісник, який є в ядрі, впливає на положення другого замісника.
Звичайно при заміщенні Гідрогену в ядрі гомологів бензолу утворюється суміш орто-, мета- і пара-замісників, у якій переважають орто- і пара-сполуки. Наприклад, при нітруванні толуолу реакція йде таким шляхом:
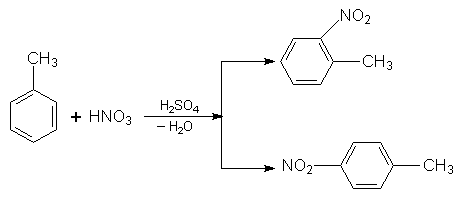
2. Галогенування. Під час галогенування гомологів бензолу з участю каталізаторів утворюються продукти заміщення Гідрогену в бензольному ядрі (реакція відбуваеться так само, як і нітрування).
Якщо хлорування здійснюють на світлі, то можуть заміщуватися на Хлор атоми Гідрогену в бічному ланцюгу, наприклад:
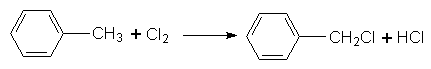
Можливе також утворення сполук С6Н5–СНСl2 і С6Н5–ССl3.
2.
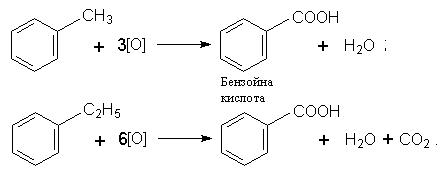 |
Окислення. Толуол, етилбензол, ксилоли та інші гомологи бензолу окислюються легше, ніж сам бензол. Окислення зазнають бічні замісники, наприклад:
3.
Добування. У промислових масштабах гомологи бензолу виділяють переважно з нафти та кам`яного вугілля.
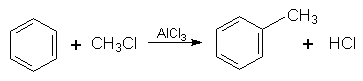 |
Ці сполуки можна добути синтетичним шляхом, наприклад за реакцією алкілування бензолу:
Алкілбензоли можна добути під час циклізації алканів:
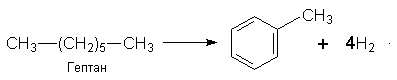
Застосування. Гомологи бензолу використовують у промисловому органічному синтезі. Толуол, наприклад, застосовують для синтезу бензойної кислоти. З пара-ксилолу добувають терефталеву кислоту, яка використовується у виробництві хімічних волокон.
Багато гомологів бензолу (толуол, ксилоли) застосовуються як розчинники органічних речовин та полімерів.
Стирол. З ароматичних вуглеводнів важливе промислове значення має стирол (вінілбензол). Молекула стиролу містить вініл (радикал етилену), який заміщує атом Гідрогену в бензольному ядрі:
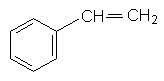
Стирол – рідина з приємним запахом. Температура кипіння 145°С. У воді розчиняється дуже мало.
Стирол добувають дегідруванням етилбензолу з участю платинових або нікелевих каталізаторів:
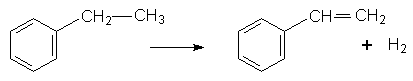
Завдяки наявності подвійного зв`язку в бічному ланцюгу стирол дуже легко полімеризується з утворенням полістиролу:
Полістирол – біла тверда речовина. З нього виготовляють електроізоляційні матеріали, різні побутові пластмасові вироби, використовують як декоративний матеріал при обладнанні приладів, машин.
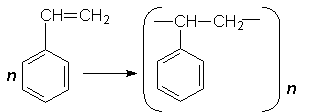
Здійснюючи полімеризацію стиролу в умовах спінення реакційної маси, добувають пінополістирол, або пінопласт. Цей полімер – злегка пориста речовина, є хорошим тепло- і звукоізолятором. Недоліком полістиролу є його мала механічна міцність. Продукт співполімеризації стиролу і бутадієну – удароміцний полістирол. Цей полімер є важливим конструкційним матеріалом, служить замінником металів і деревини.
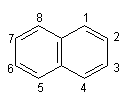 |
Нафталін. Нафталін – ароматичний вуглеводень складу С10Н8 – двох`-ядерна ароматична система:
Така система називається конденсованою. Нафталін – безбарвна кристалічна речовина з температурою плавлення 80,3°С, дуже мало розчинна у воді.
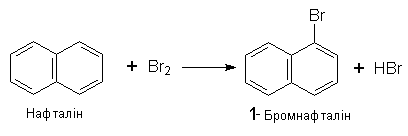 |
За хімічними властивостями нафталін подібний до бензолу – вступає в реакцію електрофільного заміщення. Йри цьому звичайно замісники займають положення 1, наприклад:
Нафталін виділяють з кам`яновугільної смоли або з продуктів переробки нафти.
Застосовується у виробництві інших органічних речовин, барвників, ліків, як засіб для боротьби з шкідливими комахами.
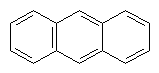 |
Антрацен. З кам`яновугільної смоли може бути виділений ще один вуглеводень, це конденсована ароматична система – антрацен. Його формула С14Н10, або
Антрацен – жовта кристалічна речовина, нерозчинна у воді. За хімічними властивостями подібний до бензолу і нафталіну. Застосовується у виробництві барвників.