КАРБОНІЛЬНІ СПОЛУКИ
Карбонільні сполуки містять у молекулі карбонільну групу С=О. Карбонільні сполуки поділяють на альдегіди і кетони.
АЛЬДЕГІДИ. НОМЕНКЛАТУРА, ВЛАСТИВОСТІ І ДОБУВАННЯ
У молекулах альдегідів карбонільна група сполучена з вуглеводневим радикалом і атомом Гідрогену (або з двома атомами Гідрогену), тобто загальна формула цих сполук
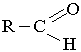
Номенклатура. Назви альдегідів за замісниковою номенклатурою згідно з правилами ІUРАК будують з назви відповідного вуглеводню з додаванням закінчення -аль. Перед коренем назви записують бічні замісники, зазначаючи їх положення і кількість. Нумерацію атомів Карбону починають з атома карбонільної групи. Приклади:
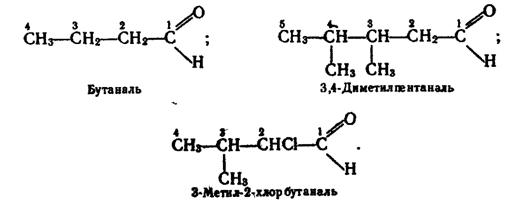
Для альдегідів широко використовують тривіальні назви, які аналогічні назвам відповідних органічних кислот (вони розглядаються далі). У табл.3 наведено назви за замісниковою номенклатурою та тривіальні назви деяких насичених альдегідів.
Як видно з табл.3, починаючи з четвертого члена ряду насичених альдегідів, існують ізомери, які різняться розгалуженістю вуглецевого ланцюга.
Таблиця 3. Деякі насичені альдегіди
Формула | Назва | |
| за замісниковою номенклатурою | тривіальна | |
нсно
СН3–СНО
СН3–СН2–СНО СН3–СН2–СН2–СНО СН3–СН(СН3)–СНО СН3–(СН2)3–СНО СН3–СН(СН3)–СН2–СНО СН3–С(СН3)2–СНО | Метаналь
Етаналь
Пропаналь Бутаналь 2-Метилпропаналь Пентаналь 3-Метилбутаналь 2,2-Диметилпропаналь | Формальдегід, мурашиний альдегід Ацетальдегід, оцтовий альдегід Пропіоновнй альдегід Масляний альдегід Ізомасляний альдегід Валеріановий альдегідІзовалеріановий альдегід Триметилоцтовий альдегід |
Властивості. Перший член гомологічного ряду насичених альдегідів НСНО – безбарвний газ, кілька наступних альдегідів – рідини. Вищі альдегіди – тверді речовини.
У карбонільній групі зв`язок між атомами Оксигену і Карбону сильно полярний: електронна густина зміщена в бік атома кисню
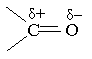
Для карбонільних сполук характерні реакції нуклеофільного приєднання. В цих реакціях нуклеофільні агенти (негативно заряджені частинки) приєднуються до атома Карбону карбонільної групи, а електрофільні агенти (позитивно заряджені частинки) приєднуються до атома Оксигену. Вплив атома Оксигену в карбонільних сполуках передається по ланцюгу. Наприклад, у сполуці, що має фрагмент
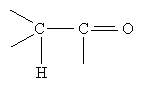
внаслідок зміщення електронної густини до Оксигену атом Гідрогену, сполучений з другим атомом Карбону, виявлятиме підвищену рухливість – його легко відірвати або замістити.
Отже, карбонільна група обумовлює високу реакційну здатність альдегідів.
1. Реакції приєднання. Альдегіди легко приєднують ціановодень НСN і гідросульфіт натрію NаНSО3:
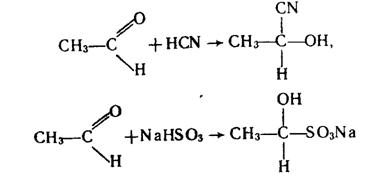
Продукти приєднання NаНSО3 – кристалічні речовини, розчинні у воді. При нагріванні з кислотами вони розпадаються з утворенням вихідного альдегіду. Тому останню реакцію використовують для очистки альдегідів.
При наявності нікелевих або платинових каталізаторів альдегіди приєднують водень і відновлюються до первинних спиртів, наприклад:
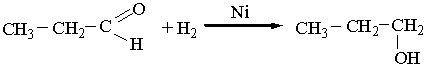
Приєднуючи спирти, альдегіди утворюють сполуки, що мають назву ацеталів. Реакція відбувається при наявності кислот:
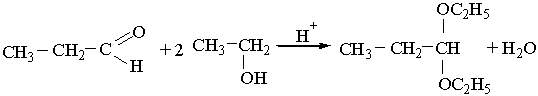
Ацеталі — це прості ефіри двохатомного спирту. Вони легко гідролізуються з утворенням вихідних речовин.
2. Реакції полімеризації і конденсації. Ці реакції характерні для альдегідів і обумовлені реакційною здатністю карбонільної групи. Процеси полімеризації розглядаються далі, при вивченні властивостей формальдегіду і ацетальдегіду.
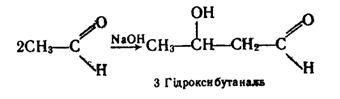
Дві молекули альдегіду можуть сполучатися одна з одною при наявності лугу з утворенням сполуки з довшим карбоновим ланцюгом, яка містить альдегідну і гідроксильну групи:
Таку речовину називають альдолем. При відщепленні молекули води від гідроксибутаналю утворюється альдегід, що містить подвійний зв`язок у ланцюгу: .
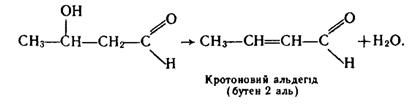
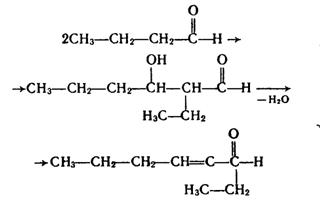
Подібні реакції конденсації альдегідів називаються реакціями альдольно-кротонової конденсації. При конденсації інших альдегідів реакція також завжди відбувається з участю другого атома Карбону однієї з молекул, наприклад:
3. Окислення. Під час окислення альдегідів, яке відбувається дуже легко, утворюються органічні кислоти або їхні солі. Наприклад, під час окислення оцтового альдегіду утворюється оцтова кислота:
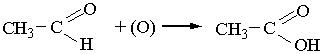
Якісною реакцією на альдегіди є реакція срібного дзеркала – окислення їх аміачним розчином оксиду срібла при нагріванні:
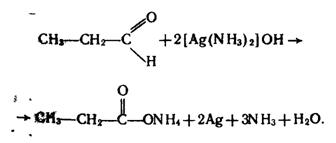
Металічне срібло, яке виділяється, вкриває стінки посудини тонким блискучим шаром.
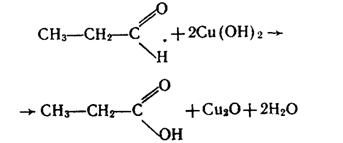
Альдегіди окислюються також Купрум (II) гідроксидом, який відновлюється до червоно-коричневого Купрум (I) оксиду:
4. Заміщення Оксигену карбонільної групи. Атом Оксигену в молекулі альдегіду може бути заміщений на галоген під дією галогенідів Фосфору РСl5 або РВr5, наприклад:
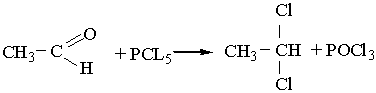
Під дією гідроксиламіну NН2ОН на альдегіди карбонільний Оксиген заміщується на оксімідну групу =N–ОН:
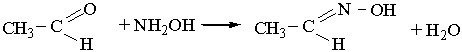
Нітрогеновмісна органічна сполука, що утворюється, належить до оксимів.
5. Взаємодія з галогенами. Як уже зазначалось, атом Гідрогену біля другого атома Карбону вуглеводневого ланцюга альдегідів має підвищену рухливість. Під час взаємодії альдегідів з хлором чи бромом цей водневий атом легко заміщується на галоген, наприклад:
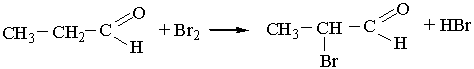
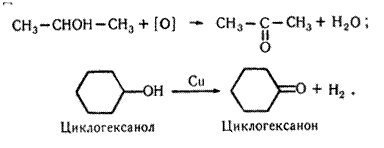
Добування. 1. Альдегіди утворюються під час окислення або каталітичного дегідрування (відщеплення водню) первинних спиртів:
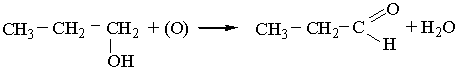
Каталітичне дегідрування спиртів відбувається при наявності металічної міді:
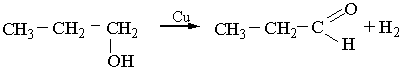
2. Альдегіди можна добути гідролізом дигалогенопохідних алканів, наприклад:
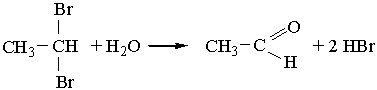
3. Альдегіди утворюються під час взаємодії алкенів з оксидом Карбону(II) і воднем (оксосинтез):
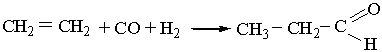
Оксосинтез відбувається при наявності каталізаторів – комплексних сполук кобальту під тиском 5–10 МПа.
ФОРМАЛЬДЕГІД, АЦЕТАЛЬДЕГІД, БЕНЗАЛЬДЕГІД
Формальдегід. Першим членом гомологічного ряду насичених альдегідів є формальдегід НСНО, який має будову:
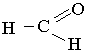
Його називають також метаналем (міжнародні номенклатура) та мурашиним альдегідом.
Формальдегід – це безбарвний газ з характерним різким запахом. Добре розчиняється у воді, утворюючи гідрат НСНО·Н2О. Водний розчин з масовою часткою формальдегіду 30–40 % називається формаліном. Формалін є добрим дезинфікуючим та консервуючим засобом.
Формальдегід є важливим продуктом хімічної промисловості. Його добувають переважно окисленням метанолу киснем повітря при наявності каталізаторів:
2СН3ОН + О2® 2НСНО + 2Н2О.
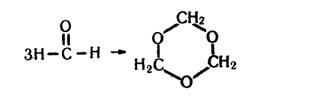
Формальдегід виявляє загальні властивості альдегідів. Крім того, має і свої особливості. Так, він може самовільно тримеризуватися (сполучення трьох молекул), утворюючи параформальдегід (триоксиметилен):
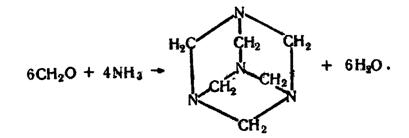
Формальдегід взаємодіє з аміаком, утворюючи циклічну сполуку гексаметилентетрамін, або уротропін:
Під дією лугів формальдегід окислюється і відновлюється одночасно, утворюючи метиловий спирт та сіль мурашиної кислоти:
2НСНО + КОН ® СН3ОН + НСООК
Формальдегід є сировиною для синтезу ізопрену, з якого добувають штучний каучук.
Важлива галузь застосування формальдегіду – виробництво полімерів. Формальдегід полімеризується з утворенням поліформальдегіду, або поліоксиметилену:
пНСНО ® (–СН2–О–)n
Поліформальдегід належить до гетероланцюгових полімерів, оскільки головний ланцюг його макромолекули містить атоми двох типів: Карбону та Оксигену.
Поліформальдегід – безбарвна кристалічна речовина. Він має механічну міцність, є добрим діелектриком. Його використовують у машинобудуванні для виготовлення різних деталей, для добування міцних синтетичних волокон і плівок.
Фенолоформальдегідні полімери. Формальдегід при наявності кислот реагує з фенолом. Реакція відбувається зіа такою схемою:
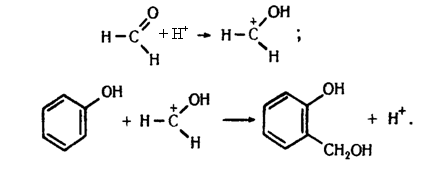
Молекули фенолоспирту, який утворюється, сполучаються між собою з утворенням макромолекул:
Продукт, що утворюється, називається фенолоформальдегідним полімером. Реакції утворення полімерів, які супроводжуються виділенням низькомолекулярного продукту, називаються реакціями поліконденсації. Під час полімеризації формальдегіду з фенолом, взятим у надлишку, як правило, утворюються лінійні полімери, які називаються новолачною смолою. Ця смола добре розчиняється в органічних розчинниках, використовується для приготування лаків.
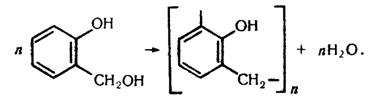 Якщо поліконденсація йде при надлишку формальдегіду, то утворюється резит – полімер, що має складну просторову структуру:
Якщо поліконденсація йде при надлишку формальдегіду, то утворюється резит – полімер, що має складну просторову структуру:
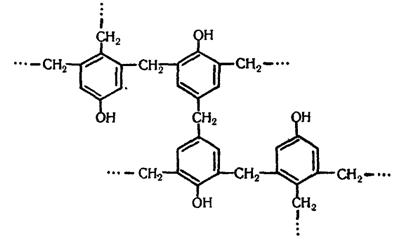
Під час добування резиту до реакційної суміші добавляють різні наповнювачі (скловолокно, азбест тощо), які надають полімеру необхідних властивостей. Загальна назва пластмас, які добувають з фенолоформальдегідного полімеру, – фенопласти.
Фенопласти є термореактивними полімерами, вони не плавляться при нагріванні, їх застосовують як конструкційний матеріал. На основі фенопластів добувають легкі пористі матеріали – пінопласти.
Ацетальдегід. Ацетальдегід (етаналь, оцтовий альдегід) – це безбарвна, рідина з різким запахом:
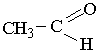
Добре розчиняється у воді.
Ацетальдегід у великих кількостях виробляє хімічна промисловість. Основний метод його промислового добування заснований на гідратації ацети-лену. Для цього ацетилен з водяною парою пропускають над каталізатором (НgSО4 з сульфатною кислотою). В результаті приєднання води до ацетилену утворюється вініловий спирт з гідроксильною групою біля подвійного зв`язку. Такі сполуки нестійкі, вініловий спирт піддається перегрупуванню в ацетальдегід:
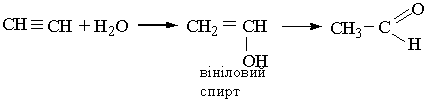
Інший метод добування ацетальдегіду полягає в каталітичному окисленні етилену киснем з участю каталізатора РdСl2 + СuСl2. Ацетальдегід добувають також окисленням чи каталітичним дегідруванням етанолу або ізомеризацією (перетворення на ізомер) етиленоксиду.
Для ацетальдегіду характерні всі хімічні властивості альдегідів. Ацетальдегід може тримеризуватися, утворюючи паральдегід:
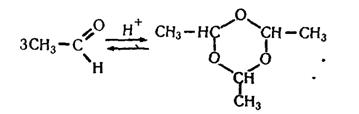
У промисловості основну кількість ацетальдегіду, який виробляють, окислюють до оцтової кислоти. Ацетальдегід використовують і для добування інших органічних продуктів, у тому числі полімерів.
Бензальдегід. Бензальдегід С6Н5COH – це безбарвна рідина з запахом гіркого мигдалю, мало розчинна у воді.
Бензальдегід добувають лужним гідролізом дихлорпохідної толуену:
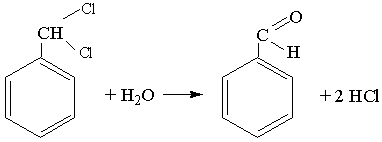
Бензальдегід застосовують у виробництві фарб, парфюмерних виробів і в харчовій промисловості.
КЕТОНИ
У молекулах кетонів карбонільна група сполучена з двома однаковими або різними вуглеводневими радикалами :
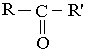
Найпростішим кетоном є ацетон :
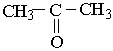
Номенклатура. Згідно з міжнародною номенклатурою назви кетонів будують з назв відповідного вуглеводню з додаванням закінчення -он. На початку назви ставлять цифру, що зазначає положення в ланцюгу атома Карбону, з яким сполучений карбонільний кисень. Нумерацію головного ланцюга починають, як завжди, з найбільш розгалуженого кінця вуглецевого ланцюга. Якщо розгалуженість однакова, то нумерують з того кінця ланцюга, до якого ближче розташована карбонільна група. Назви кетонів за раціональною номенклатурою, які також використовуються, будують з назв радикалів, сполучених з карбонільною групою з додаванням слова "кетон". Приклад:
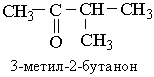
Ізомерія. Ізомерія кетонів обумовлена розгалуженістю вуглецевого ланцюга вуглеводневих радикалів і різним положенням карбонільного Оксигену.
Властивості. Простіші кетони є безбарвними рідинами, які розчиняються у воді. Вищі кетони – тверді речовини. Багато які хімічні властивості, характерні для альдегідів, виявляються і у кетонів.
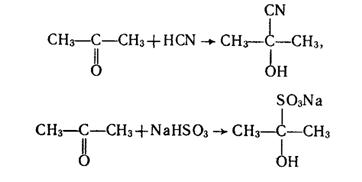 1. Реакції приєднання. Так само, як і альдегіди, кетони приєднують речовини, що містять нуклеофільні частинки, наприклад ціановодень і гідросульфіт натрію:
1. Реакції приєднання. Так само, як і альдегіди, кетони приєднують речовини, що містять нуклеофільні частинки, наприклад ціановодень і гідросульфіт натрію:
Гідрування кетонів при наявності каталізаторів приводить до утворення вторинних спиртів:
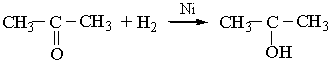
На відміну від альдегідів кетони не взаємодіють із спиртами, не вступають у реакції конденсації і полімеризації.
2. Окислення. Кетони окислюються значно важче, ніж альдегіди, і тільки сильними окислювачами. Під час окислення кетонів відбувається розрив (деструкція) вуглеводневого ланцюга і утворюється суміш продуктів. Кетони не вступають у реакцію срібного дзеркала.
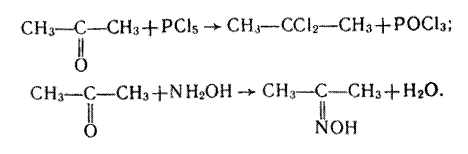
3. Заміщення Оксигену карбонільної групи. Так само, як і в альдегідах, атом Оксигену в молекулі кетону може бути заміщений дією галогенідів фосфору (РСl5, РВr5) або гідроксиламіну NН2ОН:
У першій реакції утворюється дигалогенопохідна алкану, в другій – оксим.
4. Взаємодія з галогенами. Як і альдегіди, кетони легко реагують з хлором і бромом. Атом Гідрогену, сполучений з одним із атомів Карбону, сполученим з карбонільною групою, заміщується на галоген:
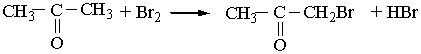
Добування. 1. Кетони утворюються під час окислення або каталітичного дегідрування вторинних спиртів, наприклад:
Каталітичне дегідрування проводять з використанням мідних каталізаторів.
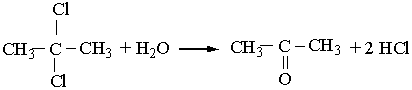
2. Як і альдегіди, кетони можна добути гідролізом дигалогенопохідних алканів. Щоб утворився кетон, обидва атоми галогену у вихідній сполуці повинні знаходитись біля одного (не кінцевого) атома Карбону:
3. Кетони утворюються внаслідок приєднання води до гомологів ацети-лену при наявності каталізаторів – солей Гідраргіруму (II), наприклад:
Н3С–СºС—СН3 + Н2О –® СН3–СН2–СО–СН3
Ацетон. Ацетон (пропанон, диметилкетон) – безбарвна рідина з характерним запахом. Температура кипіння ацетону 56,2°С. Добре розчиняється у воді і сам є розчинником органічних сполук.
Ацетон – важливий продукт хімічної промисловості. Його добувають разом з фенолом кумольним методом.
Інший промисловий спосіб полягає в гідратації пропілену до утворення спирту з наступним його каталітичним дегідруванням або окисленням:
СН3–СН=СН2 + Н2О ® СН3–СНОН–СН3;
СН3–СНОН–СН3® СН3–СО–СН3+Н2
Ацетон застосовують як розчинник. Він також є вихідною речовиною для синтезу багатьох органічних сполук.
Ацетофенон. Ацетофенон (метилфенілкетон) С6Н5–СО–СН3 – безбарвна речовина з температурою плавлення 19,6°С. У воді практично не розчиняється. Має запах черемхи. Застосовується при ви