КАРБОНОВІ КИСЛОТИ
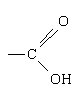 Карбоновими кислотами називаються органічні речовини, до складу яких входить карбоксильна група
Карбоновими кислотами називаються органічні речовини, до складу яких входить карбоксильна група
або спрощено —СООН.
Карбоксильна група складається із сполучених карбонільної і гідроксильної груп, що визначило її назву.
У карбонових кислотах карбоксильна група сполучена з вуглеводневим радикалом R, тому в загальному вигляді формулу карбонової кислоти можна записати так: R–соон.
У карбонових кислотах карбоксильна група може сполучатися з різними вуглеводневими радикалами – насиченими, ненасиченими, ароматичними. У зв`язку з цим виділяють насичені, ненасичені та ароматичні карбонові кислоти, наприклад:
 |
Залежно від числа карбоксильних груп, що містяться в молекулах карбонових кислот, розрізняють одноосновні та двохосновні кислоти, наприклад:
Одноосновні кислоти називають також монокарбоновими, а двохосновні – дикарбоновими кислотами.
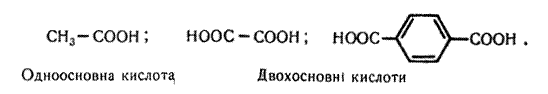
ГОМОЛОГІЧНИЙ РЯД НАСИЧЕНИХ
одноосновних кислот
Загальна формула членів гомологічного ряду насичених одноосновних карбонових кислот СnН2n+1СООН, де n = 0, 1, 2, 3…. .
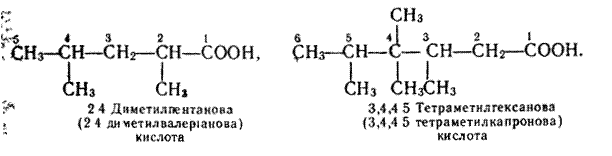
Номенклатура. Назви карбонових кислот за замісниковою номенклатурою будують з назви відповідного алкану з додаванням закінчення -ова і слова "кислота".
Якщо карбоновий ланцюг розгалужений, то на початку назви кислоти записують замісник, зазначаючи його положення в ланцюгу. Нумерацію атомів вуглецю в ланцюгу починають з Карбону карбоксильної групи. Приклади:
 |
Для деяких членів гомологічного ряду насичених карбонових кислот застосовують тривіальні назви. В табл.1 наведено формули деяких насичених одноосновних кислот і їх назви за замісниковою номенклатурою та тривіальні назви.
Таблиця 1. Деякі насичені одноосновні кислоти
| Формула | Назва | |
| за замісниковою номенклатурою | тривіальна | |
| нсоон СН3СООН С2Н5СООН С3Н7СООН С4Н9СООН С5Н11соон С6Н13СООН С15Н31соон С16Н33соон С17Н35соон | Метанова Етанова Пропанова Бутанова Пентанова Гексанова Гептанова Пентадеканова Гексадеканова Гептадеканова | Мурашина Оцтова Пропіонова Масляна Валеріанова Капронова Енантова Пальмітинова Маргаринова Стеаринова |
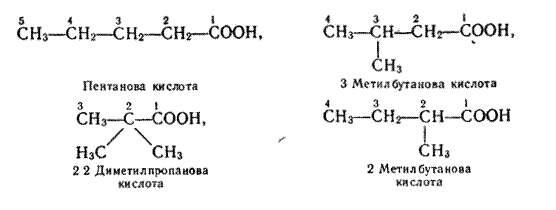
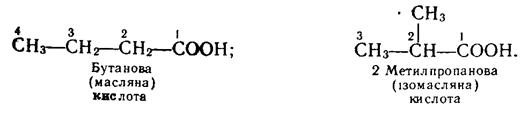 Ізомери. Починаючи з бутанової кислоти С3Н7СООН, члени гомологічного ряду насичених одноосновних кислот мають ізомери, їх ізомерія зумовлена розгалуженістю карбонового ланцюга вуглеводневих радикалів. Так, бутанова кислота має такі два ізомери (у дужках дано тривіальну назву):
Ізомери. Починаючи з бутанової кислоти С3Н7СООН, члени гомологічного ряду насичених одноосновних кислот мають ізомери, їх ізомерія зумовлена розгалуженістю карбонового ланцюга вуглеводневих радикалів. Так, бутанова кислота має такі два ізомери (у дужках дано тривіальну назву):
Формулі С4Н9СООН відповідають чотири ізомерні карбонові кислоти:
ВЛАСТИВОСТІ І ДОБУВАННЯ НАСИЧЕНИХ ОДНООСНОВНИХ КИСЛОТ
Властивості. Кислоти гомологічного ряду з нормальною будовою від мурашиної до С8Н17СООН (нонанової кислоти) за звичайних умов – безбарвні рідини, що мають різкий запах. Вищі члени ряду, починаючи з С9Н19СООН, – тверді речовини. Мурашина, оцтова і пропіонова кислоти добре розчиняються у воді, змішуються з нею в будь-яких співвідношеннях. Інші рідкі кислоти обмежено розчиняються у воді. Тверді кислоти у воді практично нерозчинні.
Особливості хімічних властивостей карбонових кислот зумовлені сильним взаємним впливом карбонільної (=С=О) і гідроксильної (–О–Н) груп.
У карбоксильній групі зв`язок між Карбоном і карбонільним Оксигеном сильнополярний. Проте, позитивний заряд на атомі Карбону частково зменшується внаслідок притягання електронів атома Оксигену гідроксильної групи. Тому в карбонових кислотах карбонільний Карбон менш схильний до взаємодії з нуклеофільними частинками, ніж в альдегідах і кетонах.
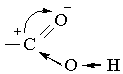 З іншого боку, під впливом карбонільної групи підсилюється полярність зв`язку О–Н за рахунок зміщення електронної густини від Оксигену до атома Карбону. Всі зазначені особливості карбоксильної групи можна проілюструвати такою схемою:
З іншого боку, під впливом карбонільної групи підсилюється полярність зв`язку О–Н за рахунок зміщення електронної густини від Оксигену до атома Карбону. Всі зазначені особливості карбоксильної групи можна проілюструвати такою схемою:
Розглянутий характер електронної будови карбоксильної групи зумовлює відносну легкість відщеплення атома водню цієї групи. Тому у карбонових кислот добре виявлені кислотні властивості. У безводному стані і особливо у водних розчинах карбонові кислоти дисоціюють на іони:
СН3–СН2–СООН ↔ СН3–СН2–СОО– + Н+.
Кислотний характер розчинів карбонових кислот можна встановити за допомогою індикаторів. Карбонові кислоти є слабкими електролітами, причому сила карбонових кислот зменшується зі збільшенням молекулярної маси кислоти.
Для насичених одноосновних кислот найбільш характерні реакції, зумовлені кислотними властивостями, а також реакції заміщення гідроксильної групи.
1. Взаємодія з металами. Карбонові кислоти реагують з деякими металами з утворенням солей і водню. Наприклад, утворення магній ацетату:
2СН3СООН + Мg ® Мg(СН3СОО)2 + Н2
2. Взаємодія з основними оксидами і основами. Як усі кислоти, карбоксильні сполуки реагують з основними оксидами і основами, наприклад:
2С2Н5СООН + МgО ® Мg(С2Н5СОО)2 + Н2О
С2Н5СООН + КОН ® С2Н5СООК + Н2О
3 водним розчином аміаку, який виявляє властивості основ, карбонові кислоти також утворюють солі:
С2Н5СООН + NН3® С2Н5СООNН4
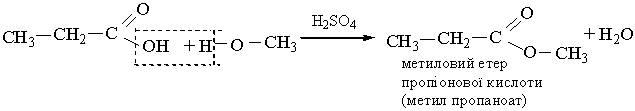
3. Взаємодія зі спиртами. Карбонові кислоти реагують зі спиртами при наявності сильних неорганічних кислот. Від молекули кислоти відщеплюється група ОН, від молекули спирту – атом Н, в результаті утворюються складні ефіри:
 |
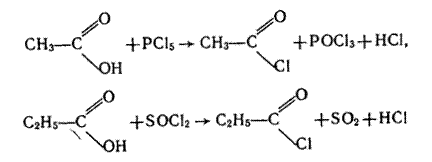
4. Взаємодія з галогенідами Фосфору і Сульфуру. Галогеніди РСl5, РСl3 і SОСl2 взаємодіють з карбоновими кислотами, утворюючи хлорангідриди кислот, наприклад:
 |
5. Взаємодія з водовідбирними агентами. Під дією сильних водовідбирних речовин, наприклад Р2О5, на карбонові кислоти утворюються ангідриди кислот:
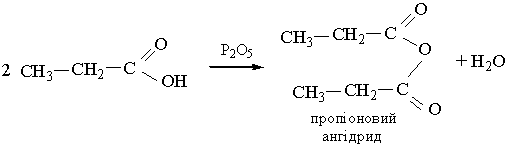 |
6. Взаємодія з галогенами. Як і в альдегідах, Хлор і Бром можуть заміщувати атом Гідрогену біля другого карбонового атома з утворенням галогенозаміщених кислот, наприклад:
СН3–СН2–СООН + Вr2® СН3–СНВr–СООН + НВr
7. Відновлення і каталітичне гідрування. Відновлюючи карбонові кислоти, можна добути альдегіди і первинні спирти, наприклад:
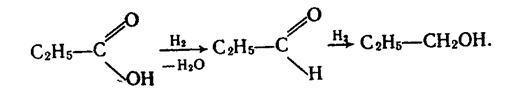 |
Відновлення кислот відбувається дуже важко.
Добування. Основні методи добування карбонових кислот такі.
1. Окислення первинних спиртів і альдегідів. Спирти і альдегіди окислюються досить легко, наприклад:
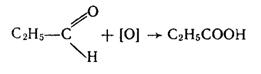 |
Під час окислення кетонів, вторинних і третинних спиртів у жорстких умовах (сильні окислювачі, нагрівання) відбувається розщеплення вуглецевого ланцюга молекул і утворюється, як правило, суміш карбонових кислот. Наприклад, окислюючи ацетон, можна добути суміш мурашиної і оцтової кислот.
2. Окислення алканів. Суміш нижчих алканів (бутан–октан) окислюється при наявності каталізаторів переважно до оцтової кислоти. Алкани, що містять 9–20 атомів Карбону, окислюються до вищих кислот.
3. Гідроліз нітрилів. Нітрили – сполуки типу R–СºN. Під час нагрівання нітрилів з водою, в яку добавлено неорганічні кислоти, утворюються карбонові кислоти, наприклад, при гідролізі акрилонітрилу утворюється акрилова кислота (пропенова):
СН3–СºN + 2Н2О ® СН3–СООН + NН3
4. Карбонілування алкенів. Кислоти, починаючи з пропіонової, можна добути приєднанням оксиду Карбону (II) і води до алкенів. Каталізатором реакції є фосфорна кислота, процес відбувається при температурі 300–350°С і тиску 20–30 МПа. Приклад:
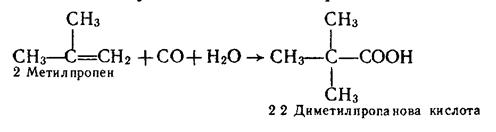 |
МУРАШИНА, ОЦТОВА ТА ВИЩІ НАСИЧЕНІ КИСЛОТИ
Мурашина кислота. Перший член гомологічного ряду насичених одноосновних карбонових кислот – мурашина (метанова) кислота НСООН:
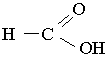
Це безбарвна рідина з різким запахом. Температура кипіння мурашиної кислоти становить 100,7°С.
Мурашина кислота міститься в їдкій речовині, яку виділяють мурашки (цим пояснюється назва кислоти). Вона міститься також у деяких рослинах, наприклад у кропиві. При потраплянні на шкіру викликає опіки.
Мурашина кислота є важливим продуктом хімічної промисловості. Основний метод добування заснований на пропусканні Карбон (II) оксиду крізь концентрований розчин Натрій гідроксиду при температурі ~200°С і тиску
1,2–1,5МПа. При цьому утворюється форміат натрію (сіль кислоти), який обробляють сірчаною кислотою:
NаОН + СО ® НСООNа;
2НСООNа + Н2SО4® 2НСООН + Nа2SО4.
У молекулі мурашиної кислоти карбоксильна група сполучена не з вуглеводневим радикалом а з атомом Гідрогену. Це надає кислоті ряд властивостей, що відрізняють її від інших карбонових кислот. Наприклад, вона найсильніша з одноосновних насичених карбонових кислот. На відміну від інших кислот гомологічного ряду мурашина кислота може бути відновником. Як і альдегіди, вона вступає в реакцію срібного дзеркала з аміачним розчином Аргентум оксиду:
НСООН + 2[Аg(NН3)2]ОН ® СО2 + 2Аg + 4NН3 + 2Н2О.
Мурашина кислота окиснюється сульфатною кислотою (концентрованою) до Карбон (II) оксиду.
Мурашину кислоту застосовують у ряді органічних синтезів, у медицині, в текстильній промисловості, як відновник.
Оцтова кислота. Оцтова (етанова) кислота СН3СООН – безбарвна рідина з характерним різким запахом. Температура кипіння 118,1°С. При температурі 16,75°С кислота твердне, утворюючи кристали, схожі на лід. Тому безводну оцтову кислоту називають льодяною оцтовою кислотою.
Добре розчиняється у воді. Її 70–80 %-й розчин називається оцтовою есенцією, а 3–6 %-й – оцтом.
Ця кислота трапляється в природі. Вона міститься у багатьох тваринних і рослинних організмах, утворюється під час скисання багатьох продуктів і вина.
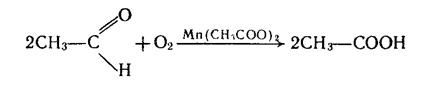 Оцтова кислота є важливим продуктом хімічної промисловості. Її добувають окисленням ацетальдегіду киснем повітря. Процес здійснюють при наявності каталізатора [манган (II) ацетату Мn(СН3СОО)2] і температурі 50–60°С:
Оцтова кислота є важливим продуктом хімічної промисловості. Її добувають окисленням ацетальдегіду киснем повітря. Процес здійснюють при наявності каталізатора [манган (II) ацетату Мn(СН3СОО)2] і температурі 50–60°С:
Оцтову кислоту синтезують також з метанолу та Карбон (II) оксиду за реакцією:
СН3ОН + СО ® СН3СООН.
Оцтова кислота є проміжним продуктом синтезу багатьох органічних речовин, барвників, штучних волокон. Її використовують також у харчових цілях для консервування продуктів і як приправу.
Вищі насичені кислоти. З вищих одноосновних насичених кислот найбільше значення мають пальмітинова кислота С15Н31СООН і стеаринова кислота С17Н35СООН. Це безбарвні тверді речовини, не розчинні у воді.
Стеаринову і пальмітинову кислоти можна виділити з рослинних і тваринних жирів. У промисловості ці кислоти добувають окисленням парафіну, який виділяють з нафти.
Стеаринова і пальмітинова кислоти виявляють багато властивостей, характерних для карбонових кислот. Практичне значення має реакція їх з лугами з утворенням солей. Солі стеаринової та пальмітинової кислот – основні компоненти мила. Стеаринову та пальмітинову кислоти застосовують у виробництві мийних засобів, лаків, фарб, лінолеуму, гуми.
До вищих ненасичених кислот належить олеїнова кислота С17Н33СООН, яка містить один подвійний зв’язок між 9 та 10 атомами Карбону. Тому олеїнова кислота реагує з бромною водою, приєднуючи бром по місцю подвійного зв’язку. При каталічному приєднанні водню утворюється стеаринова кислота.