Теоретичні відомості
Одним із типових процесів технології водоочищення і водопідготовки є іонний обмін, який здійснюється із застосуванням іонообмінних матеріалів (іонітів).
Метод іонного обміну представляє собою взаємодію розчину з твердою фазою-іонітом, що має властивості обмінювати іони, які містяться в ньому, на іоні, що знаходяться у водному розчині.
Іоніти – це нерозчинні сполуки, які містять у своєму складі функціональні групи, здатні до іонізації та обміну з електролітами. Багато іонітів існують у природному вигляді (цеоліт, алюмосилікат) та більшу частину їх отримують синтетичним шляхом.
За природою іоніти поділяють на неорганічні (мінеральні) і органічні, природні і штучні (синтетичні). До неорганічних природних іонітів належать природні цеоліти, глинисті мінерали (алюмосилікати), в тому числі бентонітові глини, глауконіт, вермикуліт, польові шпати, фельдшпатоїди, слюди, оксиди, фосфати і силікати металів (титану, кальцію, цирконію та ін.), рудні мінерали змінного складу. До неорганічних штучних іонітів відносять синтетичні цеоліти, важкорозчинні солі гетерополікислот, фероціаніди, фосфати, гідрооксиди, оксиди, сульфіди металів (цирконію, алюмінію, феруми, титану, ніколу та ін.).
До органічних природних іонообмінних матеріалів належать кам’яне вугілля і буре вугілля, торф, целюлоза. Синтетичні органічні іоніти є високомолекулярними органічними сполуками, які спрямовано синтезовані, мають сталий склад і властивості, що відтворюються в результаті різних технологічних операцій. Для них характерна висока здатність до обміну іонами, хімічна стійкість і механічна міцність. Синтетичні іоніти знайшли найбільш широке застосування в технології водопідготовки і водоочищення.
За зовнішнім виглядом і ступенем дисперсності іоніти поділяють на порошкоподібні, зернисті, гранульовані, формовані і волокнисті.
За типом і знаком протиіонів іоніти поділяють на: а) катіоніти, що здатні до обміну катіонів; б) аніоніти, що здатні до обміну аніонів; в) амфоліти, що здатні залежно від умов середовища до обміну як катіонів, так і аніонів.
Катіоніти залежно від типу протиіонів можуть перебувати у водневій (Н-формі), сольовій ( натрієвій, кальцієвій, тощо) і змішаній формах.
Аніоніти можуть бути в гідроксидній (ОН-формі), сольовій (хлоридній, сульфатній тощо) і змішаній формах.
Амфоліти бувають у воднево-гідроксильній, воднево-сольовій, гідроксильно-сольовій і сольовій формах.
Іоніти, маркують так КУ (катіоніт універсальний) – сильнокислотний катіоніт; КБ (катіоніт буферний) – слабкокислотний катіоніт; КФ – катіоніт фосфатний; АВ – аніоніт високоосновний; АН – аніоніт слабкоосновний; АНКБ – аніоніт слабкоосновний, катіоніт буферний (поліамфоліт), який містить слабкоосновні і слабкокислотні групи; АНКФ – поліамфоліт, який містить слабкоосновні і фосфатні групи і тощо.
Для завантаження Н-катіонітових фільтрів при очищенні стічних вод на даний час переважно використовують катіоніти КУ-1, КУ-2-8, КУ-2-20, КУ-23, КБ-4, КБ-4П-2, КБ-4-10П.
В якості слабо основних аніонітів можуть використовуватися: АН-2-ФН, АН-18, АН-22, АН-32, АН-221, АН-251, сильно основні аніоніти АВ-17-8, АВ-29-12П.
Регенерація іонообмінних смол полягає у відновленні початкової іонної форми смоли.
Порядок виконання роботи
Виконання роботи полягає в проведенні очищення стічної води від катіонів міді Cu2+ іонообмінним методом і визначенні ефективності даного методу.
Робота складається з декількох стадій.
Перша стадія – побудова калібрувального графіка для визначення концентрації іонів міді на фотоелектроколориметрі (ФЕК).
Друга – визначення початкової концентрації катіонів міді у стічній воді.
Третя – проведення очистки стічної води в іонообмінні колонці.
Четверта – визначення кінцевої концентрації катіонів міді у стічній воді та розрахунок ефективності очистки.
Побудова калібрувального графіка
Готуємо р-н CuSO4∙5H2O з концентрацією 0,1 моль/дм3. Для цього визначаємо молекулярну масу CuSO4∙5H2O за таблицею Менделєєва – Mr(CuSO4∙5H2O) = 63,5 + 32 + 16 ∙ 4 + 5(2∙1 + 16) = 249,5 г/моль.
За пропорцією розраховуємо кількість речовини, необхідної для приготування 0,1 молярного розчину:
1М – 249,5 г/моль;
0,1М – Х г/моль.
Х = 0,1 ∙ 249,5 / 1 = 24,95 г/моль
На технічних терезах зважуємо наважку CuSO4∙5H2O масою 24,95 г і переносимо у мірну колбу місткістю 1 дм3. Поступово додаємо дистильовану воду і ретельно перемішуємо до розчинення речовини. Після цього об’єм розчину доводимо водою до мітки і ретельно перемішуємо.
З цього розчину для побудови калібрувального графіка готуємо серію з п’яти розчинів з відомою концентрацією шляхом розведення. Для цього у мірні колби на 25 см3 вносимо такі об’єми вихідного розчину CuSO4∙5H2O, концентрація якого складає 0,1 моль/дм3: V1 = 2,5 см3; V2 = 5 см3, V3 = 12,5 см3, V4 = 17,5 см3, V5 = 20 см3. Доводимо дистильованою водою об’єм колб до мітки.
Розраховуємо концентрацію (C2і) кожного з п’яти отриманих розчинів за формулою:
С1V1=C2V2,
де С1= 0,1 – концентрація вихідного розчину CuSO4∙5H2O,
V1і – об’єм 0,1 М р-ну CuSO4∙5H2O, який було взято при приготуванні кожного з п’яти розчинів;
V2 = 25 см3 – об’єм колб, у яких готували розчини розведення.
Потім на ФЕК вимірюємо оптичну густину кожного отриманого розчину розведення. Для цього наливаємо розчин у кювету, тримаючи її за ребра і слідкуючи за тим, щоб на її поверхні не лишалось крапель води чи розчину або відбитків пальців, оскільки це буде формувати похибку вимірювання. Вставляємо кювету у вимірювальне гніздо. У гніздо порівняння встановлюємо таку ж кювету, заповнену дистильованою водою. Виставляємо світлофільтр та довжину хвилі. Ручка повинна знаходитись у положенні «вліво». Виставляємо прилад на «ноль», повертаючи маховики «грубо» і «точно» таким чином, щоб стрілка прийняла положення по шкалі на позначці «0». Далі переводимо ручку в положення «вправо» і визначаємо по шкалі оптичної густини значення, біля якого зупинилась стрілка. Воно і буде відповідати значенню оптичної густини розчину. Процедуру повторюємо для всіх зразків. Визначення потрібно проводити у порядку збільшення концентрації зразків – від першого до п’ятого.
Будуємо графічну залежність оптичної густини (Dі) розчину від його концентрації (C2і). Для цього будуємо координатну площину, де вісь Х – це концентрація розчинів, вісь Y – оптична густина. Відкладаємо п’ять точок з координатами (C2і; Dі) та з’єднуємо їх у графік прямолінійної залежності оптичної густини від концентрації.
Визначення початкової концентрації катіонів міді у стічній воді.
Вимірюємо оптичну густину розчину до очистки на фотоелектроколориметрі при довжині хвилі λ = 670, чутливостість – 2.
Використовуючи калібрувальний графік визначаємо початкову концентрацію у стічній воді. Для цього з точки по вісі Y (значення Dі), яка відповідає виміряній оптичній густині стічної води, проводимо лінію, паралельну вісі Х, до перетину з прямою графіка. З точки перетину опускаємо перпендикуляр на вісь Х і визначаємо концентрацію (Сп).
Проведення очистки стічної води в іонообмінні колонці.
Збираємо іонообмінну установку, заповнюємо її катіонітом універсальним КУ-2-8 невеликими порціями до потрібного об’єму.
Поступово заливаємо 300 см3 стічної води в іонообмінну колонку. Час перебування розчину у катіонообмінній установці 10 хв.
Далі відбираємо порцію очищеної води.
Визначення кінцевої концентрації катіонів міді у стічній воді та розрахунок ефективності очистки.
Вимірюємо оптичну густину розчину на фотоелектроколориметрі при вищевказаних параметрах. Використовуючи калібрувальний графік визначаємо концентрацію очищених стоків (Ск).
За визначеними концентраціями до очистки і після очистки розраховуємо ефективність очистки за формулою:
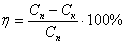 .
.