Теоретичні відомості та опис приладу.
Вільна поверхня тіл на межі фаз є причиною особливого типу явищ, так званих поверхневих явищ. Молекули поверхневого шару перебувають в особливому енергетичному стані порівняно з молекулами об`єму рідини. Щоб перевести молекули рідини з її об`єму на поверхню (для збільшення поверхні рідини), потрібно виконати роботу проти сил внутрішнього тиску. В стані стійкої рівноваги надлишкова поверхнева потенціальна енергія рідини має бути мінімальною. Тому рідина, на яку не діють зовнішні сили, за умови її практичної нестискуваності повинна набирати форму сфери. Отже, сили поверхневого шару повинні зумовлювати тенденцію рідини зменшувати свою поверхню. Зрозуміло, що ці сили мають бути напрямленими по дотичних до поверхні рідини.
Поверхневим натягом σ (або коефіцієнтом поверхневого натягу) називають величину, яка чисельно дорівнює відношенню сили ∆F, що діє на ділянку контуру поверхні рідини, до довжини ∆l цієї ділянки:
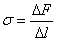 (1)
(1)Підставивши в (1) ∆F = 1Н, ∆l = 1м, дістанемо одиницю поверхневого натягу [σ] = 1 Н/м. Можливий також енергетичний перехід до тлумачення поверхневого натягу на межі двох фаз. Для збільшення поверхні рідини потрібно виконати роботу проти сил поверхневого натягу. Цю роботу при оборотному ізотермічному процесі можна виразити формулою:
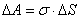 (2)
(2)де σ - питома поверхнева енергія.
Обидві величини - коефіцієнт поверхневого натягу і питома поверхнева енергія - для тієї самої рідини чисельно дорівнюють одна одній і мають ту саму розмірність (Н/м, або Дж/м2).
Коефіцієнт поверхневого натягу σ залежить від фізичних властивостей контактуючих фаз, наявності і природи домішок, температури, товщини перехідних зон між фазами тощо. Поверхневі явища відіграють особливо помітну роль у випадку високодисперсного стану речовини, коли величина поверхні розділу фаз на одиницю маси досягає великих значень. У цих випадках незначна зміна σ може приводити до суттєвих змін фізичного стану дисперсних систем. Особливо помітний вплив на величину σ спричиняють навіть незначні концентрації поверхнево-активних речовин. Найбільш відомою поверхнево-активною речовиною по відношенню до води є мило. Воно сильно зменшує її поверхневий натяг (приблизно з 7,5*10-2 до 4,5*10-2 Н/м). Поверхнево-активними речовинами, що зменшують поверхневий натяг води, є також ефіри, спирти, нафта. Існують речовини (цукор, сіль), які збільшують поверхневий натяг рідини, внаслідок того, що їх молекули взаємодіють з молекулами рідини сильніше ніж молекули рідини між собою.

рис. 1.
Із практики відомо, що вода в скляній посудині дещо піднімається там, де вона торкається стінок (рис. 1). Говорять, що вода змочує скло. Ртуть, навпаки, не змочує скло; її поверхня біля стінок опускається (рис. 2). Змочується рідиною тверде тіло, чи ні, залежить від того, що сильніше: взаємодія між молекулами рідини (когезія) чи взаємодія між молекулами рідини, з одного боку, і молекулами твердого тіла - з другого (адгезія). Сили когезії утримують разом однакові молекули, а сили адгезії діють між молекулами різного роду речовин. Вода змочує скло тому, що молекули води сильніше притягуються молекулами скла, ніж молекулами самої води. Для ртуті спостерігається зворотне: когезія виявляється сильнішою адгезії.

рис. 2.
Кут між дотичною до поверхні рідини і поверхнею твердого тіла називається крайовим кутом φ. Його величина залежить від співвідношення сил когезії і адгезії (рис. 1 і 2). Для випадку коли φ < 90о, рідина змочує тверде тіло; коли φ > 90о - не змочує. Висота h підняття (опускання) рідини в капілярі залежить від поверхневого натягу, а також від крайового кута φ і радіуса капіляра r. Для знаходження h звернемося до рис. 3.

рис. 3.
Поверхневий натяг діє під кутом φ по всьому колу радіусом r. Згідно з формулою (1) вертикальна складова сили поверхневого натягу 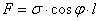 . Оскільки l = 2πr, маємо
. Оскільки l = 2πr, маємо 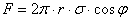 . Ця сила зрівноважується вагою стовпчика рідини, який можна вважати циліндром висотою h і об`ємом V = πr2h. Таким чином можна записати, що
. Ця сила зрівноважується вагою стовпчика рідини, який можна вважати циліндром висотою h і об`ємом V = πr2h. Таким чином можна записати, що
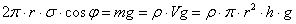 ,
,де ρ - густина рідини.
Звідси знаходимо наступний вираз для h:
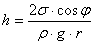 (3)
(3)Для багатьох пар речовин, таких як вода і скло, краєвий кут φ близький до нуля, і, оскільки cos 0o = 1, формула (3) набуває більш простого вигляду:
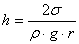 (4)
(4)Із рівності (4) визначаємо коефіцієнт поверхневого натягу σ:
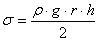 (5)
(5)Формула (5) справедлива тільки за умови повного змочування скла рідиною, через що необхідно строго слідкувати за чистотою капілярних трубок.
Капілярні трубки перед вимірюванням необхідно чисто вимити: спочатку їх промивають розчином двохромокислого калію, в сірчаній кислоті, а потім дистильованою водою і спиртом. Трубки просушуються пропусканням через них нагрітого повітря.
Як видно з формули (5), для знаходження σ треба знати такі величини: r - радіус капіляра (вказується на установці); ρ - густина рідини (беруть із довідкових таблиць); h - висота підняття рідини в капілярі (вимірюють за допомогою рідинного U - подібного манометра).
Порядок виконання роботи.
- Записати радіуси трьох капілярів (вказані на установці).
- Опустити склянку В так, щоб трубка N з`єдналась з атмосферою (рис. 4). Тоді вся система приймає атмосферний тиск. По капіляру А рідина піднімається на висоту h. В колінах манометра рідина встановлюється на одному рівні.
- Для знаходження висоти h підняття рідини в капілярі піднімають склянку В. Вода, заходячи в трубку N, стискає повітря всередині системи, і виникаючий при цьому додатковий тиск буде знижувати меніск. Треба досягти опускання меніску до рівня рідини в посудині С (для кожної трубки окремо). Очевидно, що одночасно з цієї самої причини рівень рідини у правому коліні манометра буде опускатись, а в лівому підніматись. Нехай висота підняття рівня рідини в лівому коліні манометра над рівнем рідини в правому коліні буде h1, а густина рідини ρ1. Через те що
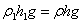 , а у випадку однакових рідин в капілярі і манометрі ρ1 = ρ , та відповідно h1 = h.
, а у випадку однакових рідин в капілярі і манометрі ρ1 = ρ , та відповідно h1 = h. - Дослід необхідно повторити по 3 рази для трьох капілярів з різними діаметрами. Знайти середнє арифметичне h для кожного капіляра і обчислити ρ та похибки вимірювань. Результати занести в таблицю 1.
Таблиця 1
| Номер досліду | h, м•10-3 | r, м•10-3 | σ, Н/м | ∆σ, Н/м | Е= ∆σсер. / σсер. • 100% | σ =(σс ± ∆σс), Н/м | |
|---|---|---|---|---|---|---|---|
| І капіляр | 1 | - | - | X | X | X | X |
| 2 | - | - | X | X | X | X | |
| 3 | - | - | X | X | X | X | |
| Середнє значення | - | - | - | X | X | X | |
| ІІ капіляр | 1 | - | - | X | X | X | X |
| 2 | - | - | X | X | X | X | |
| 3 | - | - | X | X | X | X | |
| Середнє значення | - | - | - | X | X | X | |
| ІІІ капіляр | 1 | - | - | X | X | X | X |
| 2 | - | - | X | X | X | X | |
| 3 | - | - | X | X | X | X | |
| Середнє значення | - | - | - | X | X | X | |
| Середнє значення | X | X | - | - | - | - | |