194. Хімія
2. Окисно-відновні реакції
Автор: Бубенщикова Галина Тихонiвна
| • 1 |
| Текст к ситуации | ЛАБОРАТОРНА РОБОТА № 2 "ОКИСНО-ВІДНОВНІ РЕАКЦІЇ" ЗАГАЛЬНІ ВКАЗІВКИ Виконання лабораторної роботи починається з уважного опрацювання теоретичного матеріалу теми, короткий зміст якого наведено перед завданнями до роботи. Не познайомившись з цим матеріалом, студент не зможе вірно осмислити суть хімічного експерименту, описати його та зробити висновки. Тому перед безпосереднім виконанням роботи студент повинен відповісти на ряд запитань, які мають за мету перевірити ступінь засвоєння теми, і при достатньому рівні засвоєння одержати дозвіл на виконання роботи. Після того, як всі досліди лабораторної роботи будуть виконані, зафіксовані і осмислені, студент повинен оформити журнал проведення дослідів, форму якого наведено нижче. Оформлений лабораторний журнал надсилається викладачу, який перевіряє його, робить зауваження, і зараховує (або не зараховує) лабораторну роботу, про що повідомляє студента. В даній лабораторній роботі до кожного рівняння окисно-відновної реакції треба скласти електронні рівняння !!! Без них робота не буде зарахована викладачем. |
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 2 |
| Текст к ситуации | Уважного опрацюйте теоретичний матеріал теми, короткий зміст якого наведено у файлі "Теорія". Не познайомившись з цим матеріалом, ви не зможете вірно осмислити суть хімічного експерименту, описати його та зробити висновки, пройти тестування і одержати допуск до виконання лабораторної роботи.
Лабораторна робота № 2 "Окисно-відновні процеси"І. ТЕОРЕТИЧНА ЧАСТИНА Хімічний процес, який призводить до зміни ступенів окиснення атомів реагентів, називають окисно-відновним. Ступінь окиснення – це умовний заряд атома, який визначається кількістю електронів, зміщених від менш електронегативного атома елемента до більш електронегативного атома. Атом елемента, від якого зміщено електрони, набуває позитивного значення ступеня окиснення. Атом елемента, до якого зміщено електрони, набуває негативного його значення. При визначенні ступеней окиснення елементів користуються наступними основними правилами: 1) ступені окиснення елементів в простих речовинах дорівнюють нулю: 2) алгебраїчна сума ступенів окиснення усіх атомів молекули дорівнює нулю: Н2SO4: (2 ∙ 1 + 6 + 4 ∙(–2)) = 0; 3) сталий ступінь окиснення в сполуках виявляють · елементи І групи головної підгрупи (+1): · елементи ІІ групи головної підгрупи, а також Цинк та Кадмій (+2): · Гідроген (+1): · Флуор (–1): · Оксиген (–2): · Алюміній (+3): 4) максимальний ступінь окиснення хімічних елементів (за винятком елементів І групи побічної підгрупи та VІІІ групи крім Os, Ru, Xe, а також Флуору і Оксигену) дорівнює номеру групи в періодичній системі: 5) мінімальний ступінь окиснення металів дорівнює нулю: 6) мінімальний ступінь окиснення неметалів дорівнює номеру групи періодичної системи, в якій знаходиться елемент, мінус число вісім: наприклад, для Сульфуру (VІ гр.) і Нітрогену (V гр.) мінімальні ступені окиснення відповідно дорівнюють 6 – 8 = –2 та 5 – 8 = –3: 7) слід пам’ятати, що ступінь окиснення кислотоутворюючого елемента в кислоті та будь-якій її солі − однаковий: Окиснення – це процес, що супроводжується підвищенням ступеня окиснення елемента (віддавання електронів). Відновлення – це процес зниження ступеня окиснення (приєднання електронів). Окисниками називають речовини, що містять елементи, атоми яких приймають електрони і при цьому відновлюються. До окисників відносяться: неметали (F2, O2), мінеральні кислоти, що містять кислотоутворювальні елементи у вищому ступені окиснення (HNO3, H2SO4), солі, що містять катіони у вищих ступенях окиснення (KMnO4, Fe2(SO4)3, K2Cr2O7) і ін. Відновники – це речовини, що містять елементи, атоми яких віддають електрони і при цьому окиснюються. Відновні властивості характерні майже всім металам (Mg, Al), неметалам (S, C, P), сполукам, що містять метали або неметали у нижчому ступені окиснення (Na2S, NH3, CH4). Речовини, що містять елементи у проміжному ступені окиснення, можуть проявляти окисно-відновну двоїстість, тобто бути і окисниками і відновниками (H2O2, SO2 та ін.). Метод електронного балансу При знаходженні стехіометричних коефіцієнтів окисно-відновних реакцій виходять з того, що кількість електронів, які віддає відновник, повинна дорівнювати кількості електронів, що приймає окисник. Складаючи рівняння окисно-відновних реакцій методом електронного балансу, дотримуються такої послідовності дій. Спочатку визначають ступені окиснення елементів, що входять в окисно-відновну реакцію, знаходять окисник і відновник. Наприклад: Mg0 + HN+5O3®Mg+2(NO3)2 + N+2O + H2O. Ступені окиснення змінюють Магній і Нітроген, інші елементи не змінюють свої ступені окиснення. Далі складають рівняння електронного балансу, в яких число електронів, що приєднуються (віддаються), визначається за різницею між ступенями окиснення окисника (чи відновника) до реакції і після неї: (відновник) Mg0 – 2 ē ®Mg+2 ½2 ½3 (окислюється) (окисник) N+5 + 3 ē ®N+2½3 ½2 (відновлюється) Кількість електронів, які віддає Магній Mg0, повинна дорівнювати кількості електронів, які приймає Нітроген N+5. Визначають найменше спільне кратне (6) та обчислюють коефіцієнти, ділячи найменше спільне кратне на кількість електронів у рівнянні окиснення і відновлення. Одержані цифри (3 і 2) і є реальними коефіцієнтами, які необхідно поставити перед Магнієм і Нітрогеном: 3 Mg + 2 HNO3®3 Mg(NO3)2 + 2 NO + H2O. ОскількиНітрогенуправійчастинірівняннявходитьдоскладуоднієїсполуки (HNO3), авлівійчастині – доскладудвохсполук [Mg(NO3)2іNO], токоефіцієнтпередHNO3требазмінитина 8, щобурівнятикількістьатомівНітрогену. ПотімтребаурівнятикількістьатомівГідрогенуіОксигену. Повнерівняннязапишемотак: 3 Mg + 8 HNO3®3 Mg(NO3)2 + 2 NO + 4 H2O. Приклад 2. На основі електронного балансу розставте коефіцієнти в рівнянні реакції: КІ + КМnО4 + Н2SО4® І2 + МnSО4 + К2SО4 + Н2О Розв’язання. 1) Виявляємо елементи, які змінюють ступінь окиснення: до реакції після реакції 2) Складаємо електронні рівняння окиснення та відновлення:
Коли в рівняннях реакцій після символу окисника або відновника стоїть індекс, наприклад, 2: (І2 або О2 тощо), застосовують правило подвоєння. Перед символом Іоду ставимо коефіцієнт два: 2І в правій та лівій частинах рівняння. Тоді кількість переданих електронів також подвоюється – два атоми Іоду віддають не один, а два електрони:
Це електронне рівняння можна записати і в такому вигляді:
Запишемо електронне рівняння для Мангану:
3) Складаємо електронний баланс, на основі того, що кількість електронів, вивільнена у окисно-відновному процесі відновником, дорівнює кількості електронів, приєднаних окисником. Для цього знайдемо найменше спільне кратне чисел, які показують кількість відданих та приєднаних електронів (2 і 5), з електронних рівнянь. Це десять (10). Число 10 показує, скільки електронів віддає відновник і, відповідно, приєднує окисник. Щоб досягнути цієї рівності, домножуємо рівняння (1) на 5, а − на 2. Не слід забувати, що в електронних рівняннях сума зарядів та кількість атомів елементів повинна бути однаковою в обох частинах рівняння:
4) Перед речовинами, котрі містять Манган, ставимо коефіцієнт 2 в обох частинах рівняння. З електронного рівняння реакції окиснення Іоду видно, що коефіцієнт 5 ставиться перед двома атомами Іоду (права частина рівняння). Отже, перед одними атомом Іоду (ліва частина рівняння) ставимо вдвічі більший коефіцієнт 2 ∙ 5 = 10: 10КІ + 2КМnО4 + Н2SО4® 5І2 + 2МnSО4 + К2SО4 + Н2О 5) Підбираємо коефіцієнти до інших членів рівняння у такому порядку: метали, кислотні залишки, йони Гідрогену: 10КІ + 2КМnО4 + 8Н2SО4 = 5І + 2МnSО4 + 6К2SО4 + 8Н2О 6) Щоб переконатись у правильності розставлених коефіцієнтів, порівняємо кількість атомів Оксигену в обох частинах рівняння: 40 = 40. Типи окисно-відновних реакцій Окисно-відновні процеси бувають − міжмолекулярного окиснення-відновлення, коли окисник і відновник належать до складу різних речовин:
В цій реакції залізо є відновником, а сірка − окисником. Реакції, в яких окисник і відновник входять до складу одної речовини, називаються − внутрішньомолекулярного окиснення-відновлення:
В цій реакції у складі молекули амоній дихромату Нітроген є відновником, а Хром − окисником. Реакції, в яких той самий елемент і окиснюється, і відновлюється, називаються самоокиснення-самовідновлення (диспропорціювання). Щоб мати можливість диспропорціювання, елемент повинний перебувати у стані проміжного ступеня окиснення:
У цій реакції Фосфор має проміжний ступінь окиснення +3, отже він здатний віддати ще два електрони або приєднати ще шість електронів (окисно-відновна двоїстість). З рівняння реакції видно, що три з чотирьох молекул H3РО3 є відновниками, а одна молекула є окисником. |
| 1 | Продовжити виконання лабораторної роботи | 3 |
| • 3 |
| Текст к ситуации | УВАГА! Для виконання лабораторної роботи Вам треба відповісти на декілька запитань у вигляді тестування. Допуск на виконання лабораторної роботи Ви одержуєте тільки після вірних відповідей.
Далі Вам буде запропоновано 4 питання по темі «Окисно-відновні реакції». У разі невірної відповіді хоч на одне питання результат не зараховується і Ви повертає-тесь на початок тестування. |
| 1 | Продовжити виконання лабораторної роботи | 5, 6, 7 |
| • 4 |
| Текст к ситуации | Помилка тесту.
На жаль, Ви неправильно відповіли на питання тесту, тому пропонуємо Вам уважно перег-лянути теоретичний матеріал і після цього спробувати повторно надати відповіді на питан-ня тестового контролю. |
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 5 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Вкажіть ступінь окиснення Нітрогену в нітратній кислоті: |
| 1 | +4 | 4 |
| 2 | +3 | 4 |
| 3 | +5 | 8, 9, 10 |
| • 6 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Вкажіть ступінь окиснення Сульфуру в сульфатній кислоті |
| 1 | +6 | 8, 9, 10 |
| 2 | +4 | 4 |
| 3 | +7 | 4 |
| • 7 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Вкажіть ступінь окиснення хрому у кальцій дихроматі CaCr2O7 : |
| 1 | +12 | 4 |
| 2 | + 7 | 4 |
| 3 | + 6 | 8, 9, 10 |
| • 8 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Для перетворенні S-2 → S+6 вкажіть Сульфур (-2) : а) віддає або приєднує певну кількість електронів ; б) виконує роль окисника або відновника |
| 1 | а) віддає електрони 4 електрони; б) окисник | 4 |
| 2 | а) віддає 8 електронів; б) відновник | 11, 12, 13 |
| 3 | а) приєднує 4 електрони; б) окисник | 4 |
| 4 | а) приєднує 8 електронів; б) відновник | 4 |
| • 9 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Для перетворенні Р-3 → р+5 вкажіть Фосфор (-3): а) віддає або приєднує певну кількість електронів ; б) виконує роль окисника або відновника |
| 1 | а) віддає електрони 4 електрони; б) окисник | 4 |
| 2 | а) віддає 8 електронів; б) відновник | 11, 12, 13 |
| 3 | а) приєднує 4 електрони; б) окисник | 4 |
| 4 | а) приєднує 8 електронів; б) відновник | 4 |
| • 10 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Для перетворенні Р+5 → р-3 вкажіть Фосфор (+5): а) віддає або приєднує певну кількість електронів ; б) виконує роль окисника або відновника |
| 1 | а) віддає електрони 4 електрони; б) відновник | 4 |
| 2 | а) віддає 8 електронів; б) відновник | 4 |
| 3 | а) приєднує 4 електрони; б) окисник | 4 |
| 4 | а) приєднує 8 електронів; б) окисник | 11, 12, 13 |
| • 11 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Метали у вільному стані в окисно-відновних реакціях виявлять властивості: |
| 1 | окисника | 4 |
| 2 | відновника | 14, 15, 16 |
| 3 | окисника і відновника | 4 |
| • 12 |
| Ограничение времени | 5 минут |
| Текст к ситуации | До типових окисників належать складні речовини, які містять елемент у ступені окиснення: |
| 1 | вищому | 14, 15, 16 |
| 2 | нижчому | 4 |
| 3 | проміжному | 4 |
| • 13 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Виходячи із ступеня окиснення Сульфуру у калій сульфіті, вкажіть які властивості в окисно-відновних реакціях може виявляти K2SO3: |
| 1 | окислювальні (вищий ступінь окиснення) | 4 |
| 2 | окислювальні і відновлювальні (проміжний ступ. ок.) | 14, 15, 16 |
| 3 | відновлювальні (нижчий ступінь окиснення) | 4 |
| • 14 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Виходячи із змін ступенів окиснення елементів, вкажіть тип окисно-відновної реакції: 2 H2O = 2 H2O + O2 |
| 1 | диспропорціювання | 17 |
| 2 | внутрішньомолекулярна | 4 |
| 3 | міжмолекулярна | 4 |
| • 15 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Виходячи із змін ступенів окиснення елементів, вкажіть тип окисно-відновної реакції: 4 AgNO3 = 4 Ag + 4 NO2 + O2 |
| 1 | диспропорціювання | 4 |
| 2 | міжмолекулярна | 4 |
| 3 | внутрішньомолекулярна | 17 |
| • 16 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Виходячи із змін ступенів окиснення елементів, вкажіть тип окисно-відновної реакції: 2 KClO3 = 2 KCl + 3 O2 |
| 1 | диспропорціювання | 4 |
| 2 | міжмолекулярна | 4 |
| 3 | внутрішньомолекулярна | 17 |
| • 17 |
| Текст к ситуации | Ви успішно завершили тестування. Можна приступити до виконання лабораторної роботи № 2 "ОКИСНО-ВІДНОВНІ РЕАКЦІЇ". |
| 1 | Продовжити виконання лабораторної роботи | 18 |
| • 18 |
| Текст к ситуации | Лабораторна робота № 2 "ОКИСНО-ВІДНОВНІ РЕАКЦІЇ" Звіт лабораторної роботи заповнюється у формі таблиці після виконання лабораторної роботи або після виконання кожного досліду. Ми рекомендуємо заповняти таблицю звіту після виконання кожного досліду! Ознайомтесь з повною формою оформлення звіту. На прикладі першого досліду подано зразок оформлення лабораторних дослідів. Починайте виконувати досліди. Бажаємо успіху!
МІНІСТЕРСТВО ОСВІТИ УКРАЇНИ ХМЕЛЬНИЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ Кафедра хіміїЗ В І ТВИКОНАННЯЛабораторнОЇ роботИ № 2 "ОКИСНО-ВІДНОВНІ ПРОЦЕСИ" Виконав: Студент_____________________________ Група___________________ Дослід 1. Відновлювальні властивості металів.
Дослід 2. Окиснювальні властивості калій перманганату в різних середовищах.
Дослід 3. Окисно-відновна двоїстність.
Дослід 4. Реакції внутрішньомолекулярного окиснення – відновлення.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 20 |
| • 19 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 20 |
| • 20 |
| Иллюстрация к шагу | 0194-02-020.mp4 |
| Текст к ситуации | Дослід 1(а). Відновлювальні властивості металів. Взаємодія міді з розведеною нітратною кислотою Хід виконання досліду. В пробірку з розведеною нітратною кислотою поміщаємо шматочок міді та нагріваємо до початку реакції. Який газ виділяється ? Якого ко-льору буде розчин ? Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції втаблицю звіту виконання лабораторної роботи. Складіть електронні рівняння реакції! |
| 1 | Продовжити виконання лабораторної роботи | 21 |
| • 21 |
| Иллюстрация к шагу | 0194-02-021-00.jpg |
| Текст к ситуации | Поясніть спостереження, відповівши на наступні питання. Який газ є продуктом відновлення нітратної кислоти міддю? Який колір і чому має розчин після реакції? |
| 1 | NO2 – газ інтенсивно бурого кольору; розчин блакитний, змінюється забарвлення HNO3 | 19 |
| 2 | NO – безбарвний газ, який трохи буріє на повітрі; розчин блакитний, утворюються гідратовані йони Cu2+, блакитного кольору | 22 |
| 3 | Н2 – безбарвний газ без запаху; розчин блакитний, внаслідок розчинення міді | 19 |
| • 22 |
| Текст к ситуации | Виберіть правильне рівняння реакції взаємодії міді з розведеною нітратною кислотою |
| 1 | 3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O | 23 |
| 2 | Cu + 4 HNO3 = Cu(NO3)2 + 2 NO2 + 2 H2O | 19 |
| 3 | Cu + 2 HNO3 = Cu(NO3)2 + H2 | 19 |
| • 23 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 1(а). Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 1(б). Дослід 1.Відновлювальні властивості металів.
| ||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 25 |
| • 24 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 25 |
| • 25 |
| Иллюстрация к шагу | 0194-02-025.mp4 |
| Текст к ситуации | Дослід 1(б). Відновлювальні властивості металів. Взаємодія цинку з розчином купрум(ІІ) сульфату.
Хід виконання досліду. В пробірку з розчином Купрум (ІІ) сульфату поміщаємо шматочок цинку і витримуємо 3 – 5 хвилин. Що спостерігається ? Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 26 |
| • 26 |
| Иллюстрация к шагу | 0194-02-026-00.jpg |
| Текст к ситуации | Поясніть спостереження. Що утворюється на поверхні цинкової гранули; як і чому змінюється забарвлення розчину у пробірці? |
| 1 | На гранулі - червоний осад міді; блакитний розчин (Cu2+) знебарвлюється, утворюються безбарвні йони Zn2+ | 27 |
| 2 | На гранулі - червоний осад цинк сульфату; знебарвлення розчину внаслідок розчинення цинку | 24 |
| 3 | На гранулі - червоний осад купрум(ІІ)сульфату; знебарвлення розчину, утворюється цинк сульфат (безбарвний) | 24 |
| • 27 |
| Текст к ситуации | Виберіть правильне рівняння реакції взаємодії цинку з купрум(ІІ) сульфатом |
| 1 | Zn + Cu2SO4 = ZnSO4 + 2 Cu | 24 |
| 2 | Zn + CuSO4 = CuSO4 + Cu | 28 |
| 3 | Cu + ZnSO4 = CuSO4 + Zn | 24 |
| • 28 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 1(б).
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 2.
| ||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 30 |
| • 29 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 30 |
| • 30 |
| Иллюстрация к шагу | 0194-02-030.mp4 |
| Текст к ситуации | Дослід 2. Окислювальні властивості калій перманганату в різних середовищах.
Хід виконання досліду. Проводимо реакцію окиснення натрій сульфіту калій пермангана-том в кислому середовищі. Для цього в пробірку наливаємо 3 – 4 краплі розчину калій пе-рманганату та доливаємо 2 краплі розведеної сульфатної кислоти (кисле середовище). Далі всипаємо декілька кристаликів натрій сульфіту. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 31 |
| • 31 |
| Иллюстрация к шагу | 0194-02-031-00.jpg |
| Текст к ситуации | Поясніть спостереження. Як і чому відбувається зміна забарвлення розчину? |
| 1 | Розчин знебарвлюється, тому що червоно-фіолетовий KMnO4 окиснюється до безбарвного MnSO4 | 29 |
| 2 | Розчин знебарвлюється, тому що червоно-фіолетовий Na2SO3 окиснюється до безбарвного Na2SO4 | 29 |
| 3 | Розчин знебарвлюється, тому що червоно-фіолетовий (MnO4)--йон відновлюється до безбарвного йону Mn2+ | 32 |
| • 32 |
| Текст к ситуации | Виберіть правильне рівняння реакції (з вірними коефіцієнтами) взаємодії калій перманганату з натрій сульфітом в кислому середовищі |
| 1 | 2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+K2SO4+3H2O | 33 |
| 2 | 2KMnO4+3Na2SO3+3H2SO4=2MnSO4+3Na2SO4+K2SO4+3H2O | 29 |
| 3 | 5KMnO4+2Na2SO3+3H2SO4=5MnSO4+2Na2SO4+5K2SO4+3H2O | 29 |
| • 33 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 2(а).
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 2(б).
Дослід 2. Окиснювальні властивості калій перманганату в різних середовищах.
| ||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 35 |
| • 34 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 35 |
| • 35 |
| Иллюстрация к шагу | 0194-02-035.mp4 |
| Текст к ситуации | Дослід 2. Окислювальні властивості калій перманганату в різних середовищах. Хід виконання досліду. Проводимо реакцію окиснення натрій сульфіту калій пермангана-том в нейтральному середовищі. Для цього в пробірку наливаємо 3 – 4 краплі розчину калій перманганату (не додаємо ні кислоти, ні лугу, тобто залишаємо середовище нейтральним). Далі всипаємо декілька кристаликів натрій сульфіту. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 36 |
| • 36 |
| Иллюстрация к шагу | 0194-02-036-00.jpg |
| Текст к ситуации | Поясніть спостереження. Які зміни відбуваються у пробірці (зміна звбарвлення, утворення малорозчинних сполук)? |
| 1 | Розчин змінюється з фіолетового (перманганат-йон) на бурий внаслідок утворення розчину MnO2 | 34 |
| 2 | Розчин змінюється з фіолетового (перманганат-йон) на бурий внаслідок утворення розчину MnSO4 | 34 |
| 3 | Червоно-фіолетове забарвлення перманганат-йону зникає внаслідок утворення MnO2 – бурого осаду | 37 |
| • 37 |
| Текст к ситуации | Виберіть правильне рівняння реакції взаємодії калій перманганату з натрій сульфітом в нейтральному середовищі |
| 1 | 3 KMnO4 +2 Na2SO3 + 3 H2O = 3 К2MnO4 + 2 Na2SO4 + 3 KОН | 34 |
| 2 | 2 KMnO4 + 3 Na2SO3 + H2O = 2 MnO2 + 3 Na2SO4 + 2 KОН | 38 |
| 3 | 2 KMnO4 + 3 Na2SO3 +2 H2O = 2 MnSO4 + 3 Na2SO4 + 2 KОН | 34 |
| • 38 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 2(б).
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 2(в).
| ||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 40 |
| • 39 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 40 |
| • 40 |
| Иллюстрация к шагу | 0194-02-040.mp4 |
| Текст к ситуации | Дослід 2. Окислювальні властивості калій перманганату в різних середовищах. Хід виконання досліду. Проводимо реакцію окиснення натрій сульфіту калій пермангана-том в лужному середовищі. Для цього в пробірку наливаємо 3 – 4 краплі розчину калій пе-рманганату, доливаємо 2 краплі KOH (лужне середовище). Далі всипаємо декілька криста-ликів натрій сульфіту. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 41 |
| • 41 |
| Иллюстрация к шагу | 0194-02-041-00.jpg |
| Текст к ситуации | Поясніть спостереження. Як і чому відбувається зміна забарвлення розчину: |
| 1 | Розчин знебарвлюється, тому що червоно-фіолетовий (MnO4)--йон відновлюється до безбарвного йону Mn2+ | 39 |
| 2 | Забарвлення розчину змінюється з червоно-фіолетового (MnO4-) на зелене (манганат-йон MnО42-) | 42 |
| 3 | Забарвлення розчину змінюється з червоно-фіолетового (MnO4-) на буре (манганат-йон MnО42-) | 39 |
| • 42 |
| Текст к ситуации | Виберіть правильне рівняння реакції взаємодії калій перманганату з натрій сульфітом в лужному середовищі |
| 1 | 2 KMnO4 + Na2SO3 +2 KОН = 2 MnSO4 + Na2SO4 + 2 KОН | 39 |
| 2 | 2 KMnO4 + Na2SO3 +2 KОН = 2 K2MnO4 + Na2SO4 + H2O | 43 |
| 3 | 2 KMnO4 + Na2SO3 +2 KОН = 2 K2MnO4 + Na2SO4 + 2H2O | 39 |
| • 43 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 2(в).
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 3
| |||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 45 |
| • 44 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 45 |
| • 45 |
| Иллюстрация к шагу | 0194-02-045.mp4 |
| Текст к ситуации | Дослід 3(а). Окисно-відновна двоїстність натрій нітриту
Хід виконання досліду. В пробірку наливаємо розчин калій перманганату, підкислюємо його розчином сульфатної кислоти і додаємо розчин Натрій нітриту. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 46 |
| • 46 |
| Иллюстрация к шагу | 0194-02-046-00.jpg |
| Текст к ситуации | Поясніть спостереження. Як і чому змінюється забарвлення розчину? |
| 1 | Розчин знебарвлюється, тому що червоно-фіолетовий KMnO4 окиснюється до безбарвного MnSO4 | 44 |
| 2 | Розчин знебарвлюється, тому що червоно-фіолетовий NaNO2 окиснюється до безбарвного NaNO3 | 44 |
| 3 | Розчин знебарвлюється, тому що червоно-фіолетовий (MnO4)--йон відновлюється до безбарвного йону Mn2+ | 47 |
| • 47 |
| Текст к ситуации | Виберіть правильне рівняння реакції взаємодії калій перманганату з натрій нітритом в кислому середовищі. Вкажіть які властивості (окисника чи відновника) виявляє натрій нітрит в цій реакції. |
| 1 | 5NaNO2+ 2KMnO4+ 2H2SO4= 5 NaNO3+ 2MnSO4+K2SO4+3H2O NaNO2 – окисник | 44 |
| 2 | 5NaNO2+ 2KMnO4+ 3H2SO4= 5 NaNO3+ 2MnSO4+K2SO4+3H2O NaNO2 – відновник | 48 |
| 3 | 2NaNO2+ 5KMnO4+ 3H2SO4= 2 NaNO3+ 5MnSO4+K2SO4+3H2O NaNO2 – відновник | 44 |
| • 48 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 3(а).
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 3(б) Дослід 3. Окисно-відновна двоїстність.
| ||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 50 |
| • 49 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 50 |
| • 50 |
| Иллюстрация к шагу | 0194-02-050.mp4 |
| Текст к ситуации | Дослід 3(б). Окисно-відновна двоїстність натрій нітриту
Хід виконання досліду. До підкисленого розчином сульфатної кислоти розчину калій йоди-ду додаємо декілька крапель розчину натрій нітриту. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 51 |
| • 51 |
| Иллюстрация к шагу | 0194-02-051-00.jpg |
| Текст к ситуации | Поясніть спостереження. Які зміни відбуваються у пробірці (зміна забарвлення, утворення малорозчинних сполук, виділення газу)? |
| 1 | Виділяється бурий газ NO і утворюється темно-коричневий осад йоду I2 | 49 |
| 2 | Виділяється безбарвний (трошки буріє) газ NO і утворюється темно-коричневий осад йоду I2. | 52 |
| 3 | Виділяється бурий газ I2 і утворюється темно-коричневий осад нітроген(ІІ) оксиду. | 49 |
| • 52 |
| Текст к ситуации | Виберіть правильне рівняння реакції взаємодії калій йодиду з натрій нітритом в кислому середовищі. Вкажіть які властивості (окисника чи відновника) виявляє натрій нітрит в цій реакції. |
| 1 | 2NaNO3+2KI+H2SO4= 2NO+I2+K2SO4+Na2SO4+H2O NaNO3 - окисник | 49 |
| 2 | 2NaNO2+2KI+H2SO4= 2NO+I2+K2SO4+Na2SO4+H2O NaNO2 - окисник | 53 |
| 3 | 2NaNO2+2KI+H2SO4= 2NO+I2+K2SO4+Na2SO4+H2O NaNO2 - відновник | 49 |
| • 53 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 3(б).
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до виконання Досліду 4
| |||||||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 55 |
| • 54 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 55 |
| • 55 |
| Иллюстрация к шагу | 0194-02-055.mp4 |
| Текст к ситуации | Дослід 4. Внутрішньомолекулярні окисно-відновні реакції
Хід виконання досліду. У фарфорову чашку насипаємо гіркою трохи амоній дихромату. Вносимо в нього розжарену скляну паличку. При цьому відбувається бурхлива реакція „вулкан” з утворенням зелених кристалів та виділенням газу. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Складіть електронні рівняння реакцій. |
| 1 | Продовжити виконання лабораторної роботи | 56 |
| • 56 |
| Иллюстрация к шагу | 0194-02-056-00.jpg |
| Текст к ситуации | Поясніть спостереження |
| 1 | Зелені кристали – Cr2O3; безбарвний газ – NO | 54 |
| 2 | Зелені кристали – CrO3; безбарвний газ – N2 | 54 |
| 3 | Зелені кристали – Cr2O3; безбарвний газ – N2 | 57 |
| • 57 |
| Текст к ситуации | Виберіть правильне рівняння реакції розкладу амоній дихромату. Вкажіть які властивості (окисника чи відновника) виявляють атоми Хрому та Нітрогену в цій реакції. |
| 1 | (NH4)2Cr2O7 = 2 NO + Cr2O3 + 4 H2O N-3 – відновник, Сr+6 – окисник | 54 |
| 2 | (NH4)2Cr2O7 = N2 + Cr2O3 + 4 H2O N-3 – відновник, Сr+6 – окисник | 58 |
| 3 | (NH4)2Cr2O7 = N2 + Cr2O3 + 4 H2O N-3 – окисник, Сr+6 – відновник | 54 |
| • 58 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 4.
Занесіть результати спостереження та рівняння реакцій в протокол виконання лабораторної роботи. Обов’язково складіть електронні рівняння реакції. Далі можна приступити до завершення заповнення таблиці звіту виконання лабораторної роботи.
Дослід 4. Реакції внутрішньомолекулярного окиснення – відновлення.
| |||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 59 |
| • 59 |
| Текст к ситуации | ВІТАЄМО ВАС! Ви успішно закінчили лабораторну роботу № 2 Перевірте правильність заповнення звіту виконання лабораторної роботи № 2 та надішліть його викладачу для перевірки |
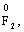
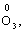
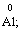
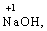
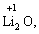
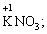
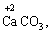
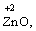
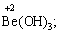
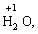
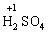 за винятком гідридів металів (–1):
за винятком гідридів металів (–1):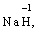
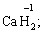
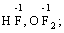
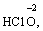
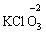 за винятком пероксидів (–1):
за винятком пероксидів (–1):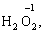
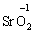 та оксиген флуориду (+2):
та оксиген флуориду (+2): 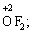
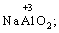
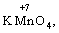
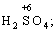
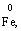
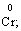
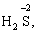
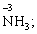
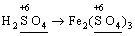
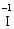 (в КІ),
(в КІ), 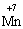 (в КМnО4);
(в КМnО4);
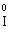 (в І2), Мn2+ (в МnSО4).
(в І2), Мn2+ (в МnSО4).
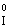
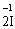 – 2ē
– 2ē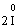
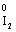 (1)
(1)
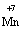 + 5ē
+ 5ē (2)
(2)

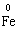 +
+ 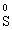 →
→ 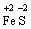
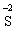 окисник (процес відновлення)
окисник (процес відновлення)
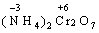 →
→ 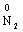 +
+ 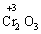 + 4Н2О
+ 4Н2О
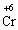 + 3ē →
+ 3ē →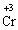 окисник (процес відновлення)
окисник (процес відновлення)
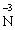 – 3ē →
– 3ē →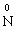 відновник (процес окиснення)
відновник (процес окиснення)
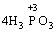 →
→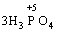 +
+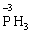
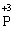 + 6ē →
+ 6ē → 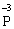 процес відновлення (окисник)
процес відновлення (окисник)
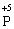 процес окиснення (відновник)
процес окиснення (відновник)
 опис)
опис)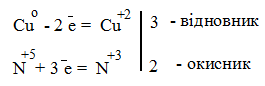
 опис)
опис)