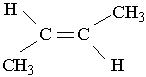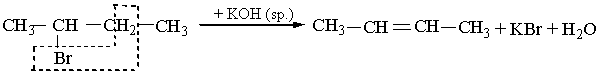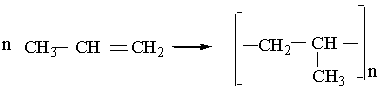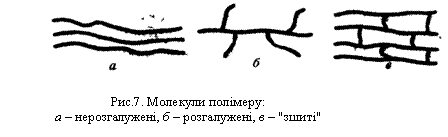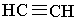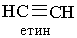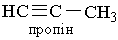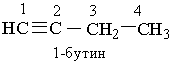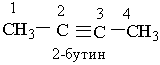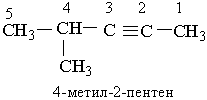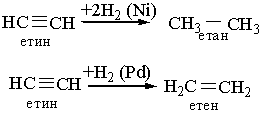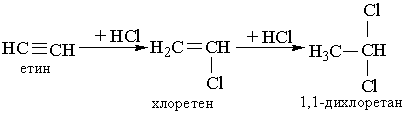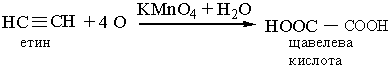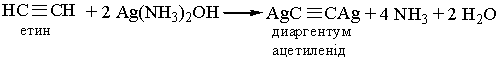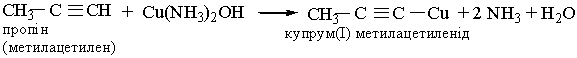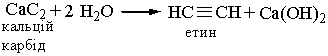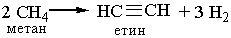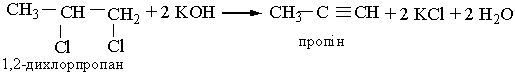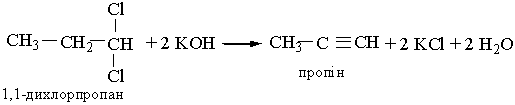194. Хімія
3. Властивостi вуглеводнiв
Автор: Бубенщикова Г.Т.
| • 1 |
| Текст к ситуации | ЛАБОРАТОРНА РОБОТА № 1 "ВЛАСТИВОСТІ ВУГЛЕВОДНІВ" ЗАГАЛЬНІ ВКАЗІВКИ Виконання лабораторної роботи починається з уважного опрацювання теоретичного матеріалу теми (відповідно до списка літератури). Не познайомившись з цим матеріалом, студент не зможе вірно осмислити суть хімічного експерименту, описати його та зробити висновки. Тому перед безпосереднім виконанням роботи студент повинен відповісти на ряд запитань, які мають за мету перевірити ступінь засвоєння теми, і при достатньому рівні засвоєння одержати дозвіл на виконання роботи. Після того, як всі досліди лабораторної роботи будуть виконані, зафіксовані і осмислені, студент повинен оформити журнал проведення дослідів, форму якого наведено нижче. Оформлений лабораторний журнал надсилається викладачу, який перевіряє його, робить зауваження, і зараховує (або не зараховує) лабораторну роботу, про що повідомляє студента. |
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 2 |
| Текст к ситуации | Уважного опрацюйте теоретичний матеріал теми. Не познайомившись з цим матеріалом, ви не зможете вірно осмислити суть хімічного експерименту, описати його та зробити висновки. |
| 1 | Продовжити виконання лабораторної роботи | 3 |
| 2 | НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ) | 101 |
| 3 | ГОМОЛОГІЧНИЙ РЯД АЛКЕНІВ | 102 |
| 4 | АЛКІНИ | 103 |
| 5 | АРОМАТИЧНІ ВУГЛЕВОДНІ | 104 |
| • 3 |
| Текст к ситуации | УВАГА! Для виконання лабораторної роботи Вам треба відповісти на декіль-ка запитань у вигляді тестування. Допуск на виконання лабораторної роботи Ви одержуєте тільки після вірних відповідей.
Далі Вам буде запропоновано 4 питання по темі «Властивості вуглеводнів: алканів, алкенів, алкінів, аренів». У разі невірної відповіді хоч на одне питання резуль-тат не зараховується і Ви повертаєтесь на початок тестування. |
| 1 | Продовжити виконання лабораторної роботи | 5, 6, 7 |
| • 4 |
| Текст к ситуации | Помилка тесту.
На жаль, Ви неправильно відповіли на питання тесту, тому пропонуємо Вам уважно перег-лянути теоретичний матеріал і після цього спробувати повторно надати відповіді на питан-ня тестового контролю. |
| 1 | Продовжити виконання лабораторної роботи | 5 |
| • 5 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Для реакції галогенування алканів вкажіть тип реакції та умови її перебігу: |
| 1 | Заміщення, звичайні умови | 4 |
| 2 | Заміщення; освітлення | 8, 9, 10 |
| 3 | Приєднання; освітлення | 4 |
| 4 | Приєднання, звичайні умови | 4 |
| • 6 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Метан одержують в лабораторії з: |
| 1 | CaCO3 | 4 |
| 2 | CH3COONa | 8, 9, 10 |
| 3 | CaC2 | 4 |
| • 7 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Виходячи з будови молекул алканів охарактеризуйте реакційну здатність алканів: |
| 1 | Містять один подвійний зв’язок, легко вступають в реакції приєднання | 4 |
| 2 | Містять один подвійний зв’язок, легко вступають в реакції заміщення | 4 |
| 3 | Містять тільки міцні одинарні сігма- зв’язки, легко вступають в реакції заміщення | 4 |
| 4 | Містять тільки міцні одинарні сігма- зв’язки, вступають в реакції заміщення в жорстких умовах | 8, 9, 10 |
| • 8 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Алкени можна одержати: |
| 1 | Міжмолекулярною дегідратацією спиртів | 4 |
| 2 | Внутрішньомолекулярною дегідратацією спиртів | 11, 12, 13 |
| 3 | Дегідруванням спиртів | 4 |
| • 9 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Якісна реакція на подвійний зв’язок це – реакція взаємодії: |
| 1 | з бромною водою | 11, 12, 13 |
| 2 | з водою в присутності каталізатора | 4 |
| 3 | з воднем в присутності каталізатора | 4 |
| • 10 |
| Ограничение времени | 5 минут |
| Текст к ситуации | При взаємодії алкенів з розведеним розчином калій перманганату утворюються: |
| 1 | карбонові кислоти та кетони | 4 |
| 2 | двохатомні спирти | 11, 12, 13 |
| 3 | одноатомні спирти | 4 |
| • 11 |
| Ограничение времени | 5 минут |
| Текст к ситуации | В промисловості ацетилен переважно одержують з: |
| 1 | метану | 14, 15, 16 |
| 2 | етану | 4 |
| 3 | кальцій карбіду | 4 |
| • 12 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Реакція взаємодії алкінів з водою в присутності солей ртуті – це реакція: |
| 1 | Вюрца | 4 |
| 2 | Коновалова | 4 |
| 3 | Кучерова | 14, 15, 16 |
| • 13 |
| Ограничение времени | 5 минут |
| Текст к ситуации | При приєднанні 2 молів водню до 1 моля ацетилену утворюється: |
| 1 | етилен | 4 |
| 2 | пропілен | 4 |
| 3 | етан | 14, 15, 16 |
| • 14 |
| Ограничение времени | 5 минут |
| Текст к ситуации | В лабораторіі бензен одержують реакцією декарбоксилювання з: |
| 1 | натрій бензоату | 17 |
| 2 | натрій феноляту | 4 |
| 3 | кальцій ацетату | 4 |
| • 15 |
| Ограничение времени | 5 минут |
| Текст к ситуации | Для ароматичних вуглеводнів найбільш властиві реакції: |
| 1 | приєднання | 4 |
| 2 | електрофільного заміщення | 17 |
| 3 | полімерізації | 4 |
| • 16 |
| Ограничение времени | 5 минут |
| Текст к ситуации | При бромуванні толуену в присутності каталізатору утворюються: |
| 1 | мета-бромтолуен | 4 |
| 2 | пара-бромтолуен та орто-бромтолуен | 17 |
| 3 | гексабромметилциклогексан | 4 |
| • 17 |
| Текст к ситуации | Ви успішно завершили тестування.
Можна приступити до виконання лабораторної роботи № 3 "ВЛАСТИВОСТІ ВУГЛЕВОДНІВ". |
| 1 | Продовжити виконання лабораторної роботи | 18 |
| • 18 |
| Текст к ситуации |
Виконав студент гр.___________ _______________________ __________ Прізвище дата ЛАБОРАТОРНА РОБОТА №3 "ВЛАСТИВОСТІ ВУГЛЕВОДНІВ" (написати назви речовин, які підкреслені в рівняннях реакцій!!!!!! Спостереження та висновки!!!!!) Дослід 1. Одержання метану і вивчення його властивостей
Спостереження:
Спостереження:
Спостереження: Висновок: Дослід 2. Одержання ацетилену та вивчення його властивостей
Спостереження:
Спостереження:
Спостереження:
Спостереження: Висновок: Дослід 3. Нітрування бензену
Спостереження: Висновок: Дослід 4. Бромуваннябензену
Cпостереження: Висновок: Дослід 4. Відношення бензену та його гомологів до розчину калій перманганату
Спостереження:
Спостереження: Висновок: |
| 1 | Продовжити виконання лабораторної роботи | 20 |
| • 19 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 20 |
| • 20 |
| Иллюстрация к шагу | 0194-03-020.mp4 |
| Текст к ситуации | Дослід 1. Одержання метану і вивчення його властивостей Хід виконання досліду. В пробірку з газовідвідною трубкою насипати безводний натрій ацетат (1 частина) та натрій гідроксид (2 частини). Нагріти пробірку. Газ, що виділяється пропустити крізь бромну воду (перша пробірка), розчин калій перманганату (друга пробірка); підпалити (реакція горіння) Уважно продивіться відеофрагмент виконання досліду, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції втаблицю звіту виконання лабораторної роботи. Зробіть висновок про реакційну здатність метану. |
| 1 | Продовжити виконання лабораторної роботи | 21 |
| • 21 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Вкажіть рівняння реакції одержання метану та рівняння горіння метану. Яким полум’ям горить метан? |
| 1 | Na2CO3 + NaOH = CH4 + CH3COONa CH4 + 2O2 = CO2 + 2H2O (блакитним полум’ям) | 19 |
| 2 | CH3COONa + NaOH = CH4 + Na2CO3 CH4 + 2O2 = CO2 + 2H2O (блакитним полум’ям) | 22 |
| 3 | Na2CO3 + NaOH = CH4 + CH3COONa CH4 + 2O2 = CO2 + 2H2O (кіптявим полум’ям) | 19 |
| • 22 |
| Текст к ситуации | Охарактеризуйте відношення метану до бромної води та калій перманганату (за звичайних умов) |
| 1 | Розчин бромної води залишається оранжевим, а калій перманганату - фіолетовим, таким чином за звичайних умов метан не реагує з Br2 та KMnO4. | 23 |
| 2 | CH4 + KMnO4 = CO2 + MnO2 + KOH (випадає бурий осад манган діоксиду); з Br2 – не реагує. | 19 |
| 3 | CH4 + Br2= CH3Br + HBr (бромна вода знебарвлюється); з калій перманганатом не реагує. | 19 |
| • 23 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду № 1
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Назвіть вихідні речовини та продукти реакцій. Далі можна приступити до виконання Досліду № 2.
ЛАБОРАТОРНА РОБОТА №3 "ВЛАСТИВОСТІ ВУГЛЕВОДНІВ" (написати назви речовин, які підкреслені в рівняннях реакцій!!!!!! Спостереження та висновки!!!!!) Дослід 1. Одержання метану і вивчення його властивостей
Спостереження:
Спостереження:
Спостереження: Висновок: |
| 1 | Продовжити виконання лабораторної роботи | 25 |
| • 24 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 25 |
| • 25 |
| Иллюстрация к шагу | 0194-03-025.mp4 |
| Текст к ситуации | Дослід № 2 . Одержання ацетилену та вивчення його властивостей
Хід виконання досліду. В пробірку з газовідвідною трубкою помістити шматочок кальцій карбіду, долити води. Газ, що виділяється : а) пропустити крізь бромну воду; б) пропустити крізь аміачний розчин аргентум (І) оксиду; в) підпалити (реакція горіння) Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції у звіт виконання лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 26 |
| • 26 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Вкажіть рівняння реакції одержання ацетилену та рівняння горіння ацетилену. Яким полум’ям горить ацетилен? |
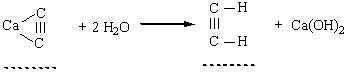
| 1 | CaC2 + 2 H2O = C2H2 + Ca(OH)2 2 C2H2 + 5 O2= 4 CO2+ 2 H2O (кіптявим полум’ям) | 27 |
| 2 | СaCO3+ 2H2O = C2H2 + CaO 2 C2H2 + 5 O2= 4 CO2+ 2 H2O (яскраим полум’ям) | 24 |
| 3 | 2 Ca2C + 8 H2O = C2H4 + 4 Ca(OH)2 C2H4 + 4 O2= 2 CO2+ 4 H2O (кіптявим полум’ям) | 24 |
| • 27 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Охарактеризуйте відношення ацетилена до бромної води та аміачного розчину аргентум (І) оксиду. |
| 1 | Не реагує з бромною водою, з аміачниім розчином аргентум (І) оксиду утворює сірий осад ацетиленіду: C2H2 + Ag2O = C2Ag2 + H2O | 24 |
| 2 | Знебарвлює бромну воду: C2H2 + 2 Br2 = C2H2Br4; З аміачниім розчином аргентум (І) оксиду утворює сірий осад ацетиленіду: C2H2 + Ag2O = C2Ag2 + H2O | 28 |
| 3 | Знебарвлює бромну воду: C2H4 + Br2 = C2H4Br2; З аміачниім розчином аргентум (І) оксиду утворює сірий осад: C2H4 + Ag2O = C2H2Ag2 + H2O | 24 |
| • 28 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 2
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Назвіть вихідні речовини та продукти реакцій. Далі можна приступити до виконання Досліду 3.
(написати назви речовин, які підкреслені в рівняннях реакцій!!!!!! Спостереження та висновки!!!!!) Дослід 2. Одержання ацетилену та вивчення його властивостей
Спостереження:
Спостереження:
Спостереження:
Спостереження: Висновок: |
| 1 | Продовжити виконання лабораторної роботи | 30 |
| • 29 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 30 |
| • 30 |
| Иллюстрация к шагу | 0194-03-030.mp4 |
| Текст к ситуации | Дослід 3. Нітрування бензену Хід виконання досліду. У пробірку до охолодженої суміші концентрованих сульфатної і нітратної кислот у співвідношенні 2:1 додати по краплях бензен (1…2 мл) при постійному перемішуванні. Потім вміст пробірки вилити у склянку з водою. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в звіт виконання лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 31 |
| • 31 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Охарактеризуйте взаємодію бензену з нітруючою сумішшю |
| 1 | Утворюється жовтий осад нітробензену: С6H6 + HNO3 = C6H5 NO2 + H2O | 29 |
| 2 | Утворюється жовта олейста рідина сульфобензену: С6H6 + H2SO4 = C6H5SO3H + H2O | 29 |
| 3 | Утворюється жовта олейста рідина нітробензену: С6H6 + HNO3 = C6H5NO2 + H2O | 32 |
| • 32 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Вкажіть тип реакції нітрування бензену. Яку роль виконує в цій реакції сульфатна кислота? |
| 1 | Електрофільне заміщення; H2SO4 - каталізатор | 33 |
| 2 | Електрофільне заміщення; H2SO4 - реагент | 29 |
| 3 | Нуклеофільне заміщення; H2SO4 - водопоглинач | 29 |
| • 33 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 3.
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Назвіть вихідні речовини та продукти реакцій. Далі можна приступити до виконання Досліду 4.
(написати назви речовин, які підкреслені в рівняннях реакцій!!!!!! Спостереження та висновки!!!!!) Дослід 3. Нітрування бензену
Спостереження: Висновок: |
| 1 | Продовжити виконання лабораторної роботи | 35 |
| • 34 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 35 |
| • 35 |
| Иллюстрация к шагу | 0194-03-035.mp4 |
| Текст к ситуации | Дослід 4. Бромування бензену Хід виконання досліду. У першій пробірці перемішати 2 мл бензену з 1…2 мл бромної води. Що при цьому спостерігається? У другу пробірку до 2 мл бензену додати 2 мл розчину брому в тетрахлоретані і 0,5 г заліз-них ошурок (залізо реагує з бромом з утворенням ферум (ІІІ) броміду, який виконує роль каталізатора). Суміш нагріти на водяні бані. До отвору пробірки піднести вологий синій лакмусовий папірець. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції у звіт виконання лабораторної роботи.. |
| 1 | Продовжити виконання лабораторної роботи | 36 |
| • 36 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Як змінюється колір бромної води у першій і другій пробірці? Чому? Рівняння реакції утворення монобромпохідної бензену. Як змінюється колір синього лакмусового папірця, піднесеного ло отвору другої пробірки? Чому? |
| 1 | У першій і у другій пробірці бромна вода знебарвлюється, відбувається реакція бромування: С6H6 + Br2 = C6H5Br + HBr. Синій лакмусовий папірець червоніє, оскільки утворюється бромбензен. | 34 |
| 2 | У першій пробірці колір бромної води не змінюється, бензен не реагує з бромною водою за звичайних умов. У другій – знебарвлюється, утворюється безбарвний бромбензен: С6H6 + HBr = C6H5Br +.Н2 Синій лакмусовий папірець червоніє, оскільки утворюється бромбензен | 34 |
| 3 | У першій пробірці колір бромної води не змінюється, бензен не реагує з бромною водою за звичайних умов. У другій (в присутності каталізатора FeBr3) – знебарвлюється, утворюється безбарвний бромбензен: С6H6 + Br2 = C6H5Br + HBr Синій лакмусовий папірець червоніє, оскільки видділяється гідроген бромід | 37 |
| • 37 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Які дибромпохідні можуть утворюватись в цій реакції? Чому? |
| 1 | мета-дибромбезен (атом брому – замісник ІІ роду) | 34 |
| 2 | мета-дибромбезен та орто-дибромбезен (не має значення у якого атома Карбону відбувається заміщення) | 34 |
| 3 | орто-дибромбезен та пара-дибромбезен (атом брому – замісник І роду) | 38 |
| • 38 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 4.
Рекомендуємо занести результати спостереження у таблицю звіту виконання лабораторної роботи. Складіть схему бромування бензену в присутності каталізатору з утворенням моно- та дибромпохідних. Назвіть вихідні речовини та продукти реакцій. Далі можна приступити до виконання Досліду 5.
(написати назви речовин, які підкреслені в рівняннях реакцій!!!!!! Спостереження та висновки!!!!!) Дослід 4. Бромування бензену
постереження: Висновок: |
| 1 | Продовжити виконання лабораторної роботи | 40 |
| • 39 |
| Текст к ситуации | Помилка тесту виконання лабораторної роботи.
На жаль, Ви обрали неправильний варіант відповіді. Вам необхідно повторити цей дослід лабораторної роботи. |
| 1 | Продовжити виконання лабораторної роботи | 40 |
| • 40 |
| Иллюстрация к шагу | 0194-03-040.mp4 |
| Текст к ситуации | Дослід 5. Відношення бензену та толуену до розчину калій перманганату Хід виконання досліду. В першу пробірку налити 2 мл бензену, в другу – 2 мл толуену. В обидві пробірки прилити по 2 мл розчину калій перманганату та по 2…3 краплі розчину сульфатної кислоти. Перемішати вміст пробірок. Уважно продивіться схему досліду та відеофрагмент його виконання, дайте відповідь на наступні питання, занесіть результати спостереження та рівняння реакції в протокол виконання лабораторної роботи. Зробіть висновок про відношення бензену та цого гомологів до дії калій пермангату.. |
| 1 | Продовжити виконання лабораторної роботи | 41 |
| • 41 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Поясніть спостереження та виберіть правильне рівняння реакції: |
| 1 | В першій і в другій пробірці розчин знебарвлюється, тому що червоно-фіолетовий (MnO4)--йон відновлюється до безбарвного йону Mn2+, бензен і толуен окиснюються з утворенням бензойної кислоти: С6H6 + [O] → C6H5COOH С6H5CH3 + [O] → C6H5COOH | 39 |
| 2 | В першій пробірці змін не відбувається, оскільки бензен не реагує з KMnO4; в другій пробірці розчин знебарвлюється, тому що червоно-фіолетовий (MnO4)--йон відновлюється до безбарвного йону Mn2+, толуен окиснюються з утворенням бензойної кислоти: С6H5CH3 + [O] → C6H5COOH | 42 |
| 3 | І в першій і в другій пробірках змін не відбувається | 39 |
| • 42 |
| Ограничение времени | 10 минут |
| Текст к ситуации | Порівняйте здатність бензена та толуена до окиснення калій перманганатом |
| 1 | Бензен і толуен однаково легко окиснюються KMnO4 | 39 |
| 2 | Бензхольне ядро стійке до дії KMnO4, а толуен реагує за рахунок бокової метильної групи, яка окиснюється до карбоксильної групи | 43 |
| 3 | Бензен і толуен стійкі до дії звичайних окиснювачів | 39 |
| • 43 |
| Текст к ситуации | Ви успішно завершили виконання Досдіду 5. Це останній дослід лабораторної роботи.
Рекомендуємо занести результати спостереження та рівняння реакцій у таблицю звіту виконання лабораторної роботи. Назвіть вихідні речовини та продукти реакцій. Далі можна приступити до завершення заповнення таблиці звіту виконання лабораторної роботи.
(написати назви речовин, які підкреслені в рівняннях реакцій!!!!!! Спостереження та висновки!!!!!) Дослід 4. Відношення бензену та його гомологів до розчину калій перманганату
Спостереження:
Спостереження: Висновок: |
| 1 | Продовжити виконання лабораторної роботи | 44 |
| • 44 |
| Текст к ситуации | ВІТАЄМО ВАС! Ви успішно закінчили лабораторну роботу № 3 Перевірте правильність заповнення звіту виконання лабораторної роботи № 3 та надішліть його викладачу для перевірки (на адресу деканату заочного дистанційного навчання) |
| • 101 |
| Текст к ситуации | НАСИЧЕНІ ВУГЛЕВОДНІ (АЛКАНИ)Алкани є найпростішими вуглеводнями. Всі атоми Карбону в молекулах алканів сполучені один з одним простими, одинарними зв`язками. Алкани називають також парафінами, насиченими вуглеводнями. ГОМОЛОГІЧНИЙ РЯД АЛКАНІВМетан. Найпростіший алкан – метан СН4, молекула якого складається з одного атома Карбону і чотирьох атомів Гідрогену.
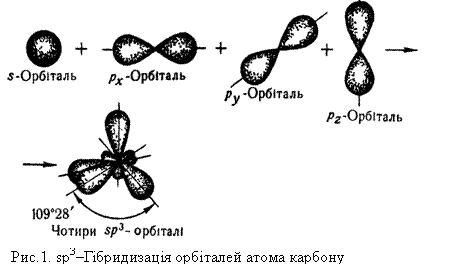
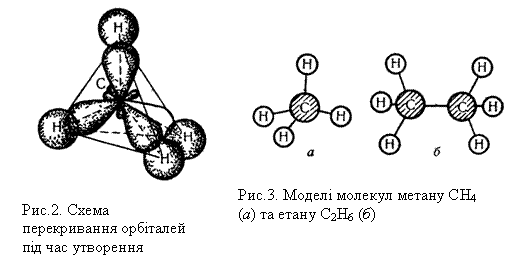
Як уже зазначалось, атом Карбону, що утворює чотири ковалентних зв`язки, знаходиться у збудженому стані (1s22s12р3). В утворенні чотирьох ковалентних зв`язків беруть участь одна s- і три р-орбіталі (рх, ру, рz) зовнішнього енергетичного рівня одного атома Карбону. Всі чотири ковалентних зв`язки, які утворює Карбон у молекулі СН4, рівноцінні: мають однакову довжину, енергію зв`язку та інші властивості. Рівноцінність хімічних зв`язків у метані можна пояснити, використовуючи поняття про гібридизацію орбіталей. Гібридизацією називається зміна форми і енергії різних орбіталей одного атома, яка приводить до утворення однакових (гібридизованих) орбіталей. Наприклад, при утворенні молекули метану гібридизації зазнають орбіталі атома Карбону: одна s- і три р-орбіталі. Вид і число орбіталей, які беруть участь у гібридизації, визначають її тип. Так, у метані виявляється sр3-гібридизація. Рис.1 показує, як з однієї s- і трьох р-орбіталей утворюється чотири однакові гібридизовані sр3-орбіталі. У просторі ці орбіталі розміщені одна відносно одної під однаковими кутами і напрямлені до вершин тетраедра. Під час утворення молекули метану СН4, sр3-гібридизовані орбіталі атома Карбону перекриваються з s-орбіталями атомів Гідрогену, що зображено на рис.2. Гібридизовані орбіталі атома Карбону напрямлені до вершин уявного тетраедра, що пояснює тетраедричну форму молекули метану. Будову молекули метану можна зобразити також за допомогою кулестержневої моделі, показаної на рис.3, а. У цій моделі атоми умовно позначаються кулями, а хімічні зв`язки – стержнями, що сполучають кулі, Гомологи метану. Крім метану всі інші вуглеводні, що належать до алканів, містять у складі молекули два, три і більше вуглецевих атомів: СН4 — метан С8Н18 — октан С2Н6 — етан С9Н20 — нонан С3Н8 — пропан С10Н22 — декан С4Н10 —бутан С11Н24 — ундекан С5Н12 — пентан ………………………. С6Н14 — гексан С20Н42 — ейкозан С7Н16 — гептан ………………………. Як видно з наведених формул, кожний наступний член цього ряду можна одержати, додаючи до формули попереднього члена групу СН2. Група СН2 називається гомологічною різницею. Речовини, подібні за хімічними властивостями, склад яких відрізняється на ціле число груп СН2, називаються гомологами. Сукупність гомологів складає гомологічний ряд. Склад молекул усіх алканів відповідає загальній формулі СnН2n+2, де
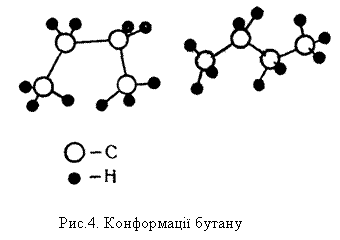
Будова молекул алканів, згідно з сучасними елетронними уявленнями про хімічний зв`язок, пояснюється так. У молекулах усіх алканів орбіталі атомів Карбону перебувають у стані sр3-гібридизації і напрямлені до вершин уявного тетраедра з їх центрів. Молекулу етану можна уявити як два тетраедри, сполучені вершинами. Кулестержнева модель молекули етану показана на рис.3, б. При такому сполученні групи СН3 можуть обертатися відносно зв`язку Карбон – Карбон, утворюючи різні геометричні форми – конформації. Будову молекул решти алканів можна уявити як сполучення великої кількості тетраедрів. При цьому за рахунок вільного обертання груп навколо зв`язку С – С можливе утворення різних конформацій. На рис.4 показано дві з можливих конформацій бутану. Ізомерія. Для алканів характерна структурна ізомерія, яка зумовлена можливістю розгалуження вуглецевого ланцюга молекули. Вуглеводень з прямим, нерозгалуженим ланцюгом називається нормальним ізомером. У алканах з розгалуженим, ланцюгом замісники (бічні ланцюги) можуть займати різне положення відносно головного ланцюга. Речовини, що мають однаковий склад, але різняться будовою вуглецевого ланцюга, називаються структурними ізомерами.
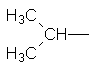
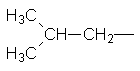
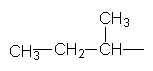
СН3–СН2–СН2–СН3, Нормальний бутан Ізобутан Ізомери бутану різняться властивостями. Так, температура кипіння нормального бутану становить –0,5°С, а ізобутан кипить при температурі –11,7°С. У іншого представника ряду алканів – гексану С6Н14 існує п`ять структурних ізомерів. Один з них н-гексан (нормальний гексан, буква н означає "нормальний") має прямий, нерозгалужений ланцюг, що складається з шести атомів Карбону, у двох ізомерів головний ланцюг містить п`ять атомів Карбону і, нарешті, можливі ще два ізомери, які мають у головному ланцюгу по чотири атоми Карбону:
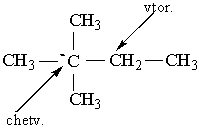
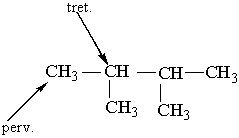
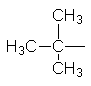
Як можна бачити із структурних формул ізомерів, атоми Карбону можуть бути сполучені з різною кількістю інших атомів Карбону: одним, двома, трьома та чотирма. Залежно від цього розрізняють первинні (perv.), вторинні (vtor.), третинні (tret.) та четвертинні (chetv.) карбонові атоми. Число ізомерів у алканів може бути різним. Воно зростає в міру збільшення числа атомів Карбону в молекулі алкану. Так, бутан має 2 ізомери, пентан – 3, гексан – 5, гептан – 9, октан – 18, нонан – 35, декан – 75 і т. Д. Ейкозан С20Н42 має вже 366319 ізомерів. Вуглеводневі радикали. Якщо від молекули вуглеводню відщепити один або кілька атомів водню, то утвориться вуглеводневий радикал. Назви радикалів утворюють від назв відповідних алканів з заміною закінчення -ан на -ил СН3– С2Н5– СН3–СН2–СН2– СН3–СН2–СН2–СН2– Метил Етил н–Пропил н–Бутил
Ізопропил Ізобутил втор–Бутил трет–Бутил
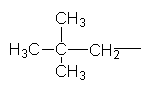
Ізопентил Неопентил Як загальна назва вуглеводневих радикалів прийнятий термін "алкіл", їх позначають буквою R . Номенклатура. Хімічна номенклатура — це система формул і назв хімічних речовин. Вона охоплює правила складання формул і назв. Для органічної хімії найбільш зручною є замісникова номенклатура, яка рекомендована ІUРАС (Міжнародна спілка теоретичної і прикладної хімії). Для того щоб дати розгалуженому вуглеводню назву згідно з цією номенклатурою, необхідно виконувати такі правила. Вибирають найдовший (головний) ланцюг атомів вуглецю в молекулі, нумерують атоми вуглецю в головному вуглеводневому ланцюгу, починаючи з того кінця, до якого ближче розміщені розгалуження (приклад а). Якщо замісники знаходяться на рівних віддалях від кінця ланцюга, то нумерацію починають з більш розгалуженого кінця (приклад b). Якщо розгалуженість головного ланцюга однакова, то нумерацію починають з того кінця, до якого ближче знаходиться радикал, назва якого стоїть раніше в алфавітному порядку (приклад c). Приклади:
За основу (корінь) назви розгалуженого вуглеводню беруть назву вуглеводню, що відповідає головному (пронумерованому) ланцюгу. Наприклад, якщо головний ланцюг містить 4 атоми Карбону, коренем буде "бутан", 9 атомів Карбону – корінь "нонан". Назва розгалуженого вуглеводню будується в такій послідовності: спочатку зазначається цифра, що означає номер атома Карбону в головному ланцюгу, у якого є розгалуження (бічний ланцюг), потім назва радикала у бічному ланцюгу і назва найголовнішого ланцюга (корінь). Якщо вуглеводень містить кілька однакових радикалів, то в його назві перелічуються цифри, що вказують їх положення, а число цих радикалів зазначається числовим префіксом: ди- (два), три- (три), тетра- (чотири), пента- (п`ять). Різні за будовою радикали перелічують в алфавітному дорядку (за першою буквою в їх назві). Приклади:
2-метилпентан
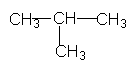
4-етил-2,3-диметилгексан Для багатьох органічних речовин, у тому числі і для деяких алканів, зберігаються тривіальні назви, тобто назви, що склалися історично. Наприклад, ВЛАСТИВОСТІ, ДОБУВАННЯ 1 ЗАСТОСУВАННЯ АЛКАН1В Властивості. За звичайних умов метан, етан, пропан, ізомерні бутан і неопентан – безбарвні гази. Нормальні алкани, починаючи з вуглеводню С17Н36 (температура плавлення 22,5°С), за звичайних умов є твердими речовинами. Усі алкани дуже мало розчинні у воді. У хімічному відношенні алкани – інертні речовини, що визначається міцністю зв`язків Карбон – Карбон і Карбон – Гідроген. Крім того, ці зв`язки малополярні, тому для алканів будуть характерні реакції, що відбуваються з гемолітичним розривом зв`язків. Реакції з участю алканів, як правило, ініціюються (викликаються) високою температурою, електромагнітним випромінюванням, прискорюються каталізаторами. Для алканів характерні такі реакції. 1. Галогенування (заміщення водню на галоген). Алкани можуть реагувати з хлором, бромом, якщо реакція ініціюється світлом. Розглянемо як приклад хлорування метану. На світлі відбувається гемолітичний розрив молекул хлору з утворенням радикалів Сl·, і далі реакція відбувається за ланцюговим механізмом: Сl2® 2Сl·СН4 + Сl·®·СН3 + НСl ·СН3 + Сl2® СН3Сl + Сl· і т. Д. Продуктами реакції можуть бути СН3Сl (метилхлорид, або хлорметан), СН2Сl2 (метиленхлорид, або дихлорметан), СНСl3 (хлороформ) і ССl4 (тетра-хлорид Карбону, або чотирихлористий вуглець). Кожний з названих продуктів можна виділити. 2. Нітрування (заміщення водню на нітрогрупу). Алкани вступають у реакцію з азотною кислотою при нагріванні, наприклад: СН4 + НNО3® СН3NО2 + Н2О.Ці реакції відкриті російським хіміком М.І.Коноваловим і дістали назву реакції Коновалова. Нітрування можна здійснювати не тільки азотною кислотою а й оксидами азоту (IV) NО2 або N2О4. Реакції заміщення атомів Гідрогена на атоми галогенів, нітро-групу найлегше відбуваються біля третинного атому Карбону, що пояснюється найбільшою стійкістю третинних радикалів. Наприклад:
3. Окислення. Алкани згоряють на повітрі з виділенням великої кількості теплоти: СН4 + 2О2® СО2 + 2Н2О; С3Н8 + 5О2® 3СО2 + 4Н2О. На реакціях горіння алканів грунтується їх застосування як палива. При невеликих температурах і наявності каталізаторів алкани можна окислити до органічних кислот. 4. Взаємодія з водяною парою. Важливе практичне значення має реакція метану з водою при високій температурі (800°С) – конверсія метану з водяною парою: СН4 + Н2О ® СО + 3Н2. Реакція відбувається при наявності каталізатора, її продуктом є синтез-газ – суміш оксиду Карбону (II) з воднем. Синтез-газ широко використовується в органічному синтезі. 5. Крекінг. Розщеплення молекул органічних сполук з розривом зв`язків Карбон – Карбон під дією високих температур називається крекінгом. Під час крекінгу алканів утворюються алкани з меншим числом атомів вуглецю і ненасичені сполуки (іноді водень), наприклад: С4Н10® СН4 + С3Н6 або С4Н10® С2Н6 + С2Н4. Добування. Промислові способи добування алканів грунтуються на виділенні їх з природних речовин, переважно нафти і природного газу. Головною складовою частиною горючих природних газів і рудникового газу, який накопичується під землею (в шахтах, рудниках), є метан; його об`ємна частка може встановити до 98 %. З природних газів можна виділити також етан, пропан, бутан, ізобутан. Ці і більш тяжкі вуглеводні виділяють з нафти. Метан та інші алкани утворюються під дією водню на вугілля при високій температурі: С + 2Н2®СН4. Такі реакції здійснюють на практиці при гідруванні вугілля (приєднання водню). Суміш алканів можна добути при нагріванні суміші оксиду Карбону (II) з воднем над каталізатором: nСО + (2n+1)Н2® СnН2n+2 + nН2О. У лабораторних умовах метан можна добути, використовуючи такі реакції: – розкладання карбіду алюмінію водою: Аl4С3 + 12Н2О ® 3СН4 + 4Аl(ОН)3, – сплавляння ацетату натрію з лугом [звичайно беруть натронне вапно – суміш NаОН і Са(ОН)2]: СН3СООNа + NаОН ® СН4 + Nа2СО3 Інші алкани можна добути при дії металічного натрію на галогенопохідні вуглеводнів, наприклад: 2С2Н5Сl + 2Nа ® С4Н10 + 2NаСl Реакції такого типу називаються реакцією В ю р ц а. Застосування. Насичені вуглеводні широко використовуються в органічному синтезі. З них добувають багато органічних речовин: ненасичені вуглеводні, хлоропохідні, органічні кислоти. Багато вуглеводнів входить до складу різних видів палива: горючого газу, бензину, гасу. З вищих алканів виготовляють такі речовини, як парафін і вазелін, мастила, електроізолятори. Вищі алкани є сировиною для добування синтетичних мийних засобів. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 102 |
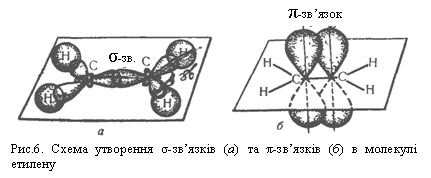
| Текст к ситуации | ГОМОЛОГІЧНИЙ РЯД АЛКЕНІВ Алкени – вуглеводні, в молекулах яких є один подвійний зв`язок між атомами Карбону С=С. Алкени називають також олефінами, або етиленовими вуглеводнями.
Такий тип гібридизації (sр2-гібридизація) спостерігається при утворенні молекули етилену С2Н4. Розміщення трьох гібридизованих sр2-орбіталей атома Карбону у просторі зображене на рис.5. Осі симетрії цих орбіталей лежать в одній площині і розміщені одна відносно одної під кутом 120°. Негібридизована р-орбіталь атома (на рисунку не показана) напрямлена перпендикулярно до площини гібридизованих орбіталей.
Під час зближення двох атомів Карбону відбувається також взаємодія негібридизованих р-орбіталей шляхом бічного їх перекривання, як зображено на рис.6, б. Зв`язок, утворений електронами, що перебувають на таких орбіталях, називається π-зв`язком. Отже, подвійний зв`язок у молекулі етилену складається з одного σ- і одного π-зв`язків. Подвійний зв`язок міцніший від одинарного, але не в два рази. Зв`язки σ- і π- різняться за міцністю, більш стійкий σ-зв`язок. У структурних формулах σ- і π-зв`язки зображають однаково (рискою), проте слід пам`ятати про різну природу і міцність цих зв`язків. Гомологи етилену. Етилен С2Н4 – перший член гомологічного ряду алкенів. Послідовно додаючи до формули гомологічну різницю СН2, можна одержати формули гомологів етилену: С3Н6, С4Н8, С5Н10 і т. Д. Загальна формула вуглеводнів ряду алкенів СnН2n , де n = 2, 3, 4 … . Назви алкенів за міжнародною номенклатурою утворюють з назв алканів з такою самою кількістю вуглецевих атомів, замінюючи закінчення -ан на -ен, наприклад, етан С2Н6 – етен С2Н4, пропан С3Н8 – пропен С3Н6, бутан С4Н10 – бутен С4Н8. Для найпростіших алкенів поширені також тривіальні назви, наприклад: етилен (етен), пропілен (пропен), бутилен (бутен). Алкени утворюють радикали. Назва радикала складається з назви відповідного алкану і суфікса -іл; для радикалів найпростіших алкенів використовують тривіальні назви, наприклад: СН2=СН– ; СН2=СН–СН2– . Вініл (етеніл) Аліл (пропеніл) Ізомерія. Для алкенів характерні два види ізомерії. Структурна ізомерія пов`язана з різним положенням подвійного зв`язку у вуглеводневому ланцюгу і з розгалуженням ланцюга. Наприклад, бутен має такі ізомери:
Назви алкенів утворюють так. Вибирають найдовший вуглеводневий ланцюг, який містить подвійний зв`язок. Нумерують атоми Карбону в цьому ланцюгу, починаючи з того кінця, до якого ближче розміщений подвійний зв`язок. За основу (корінь) назви ізомера беруть назву алкену, що відповідає головному ланцюгу. Наприклад, бутен, якщо головний ланцюг містить 4 атоми Карбону, пентен – 5 атомів С, октен – 8 атомів С. У назві алкену перед коренем зазначають бічні замісники (радикали), перед якими ставлять цифру, що вказує їх положення. Перед коренем записують номер вуглецевого атома (найменший), біля якого знаходиться
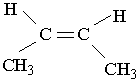
1-бутен 3-метил-2-пентен Другий характерний вид ізомерії вуглеводнів з подвійним зв`язком – це просторова ізомерія, або стереоізомерія. Вона зумовлена різним положеннням замісників відносно площини, в якій розміщені подвій-; ні зв`язки. Для позначення стереоізомерів алкенів використовують префікси цис- і транс-. Наприклад, бутен-2 має такі стереоізомери:
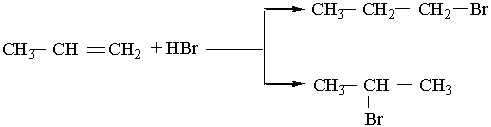
цис-2-бутен транс-2-бутен У молекулі цис-ізомеру алкільні радикали розміщені по один бік від площини подвійного зв`язку, в молекулі транс-ізомеру – по різні боки. Перехід від цис-2-бутену до транс-2-бутену і навпаки можливий тільки під час розриву π-зв`язку між вуглецевими атомами. Цис- і транс-ізомер різняться за властивостями. Наприклад, температура кипіння цис-2-бутену дорівнює 3,7°С, а транс-2 -бутену- +1°С. ВЛАСТИВОСТІ, ДОБУВАННЯ І ЗАСТОСУВАННЯ АЛКЕНІВ Властивості. Етен (етилен), пропен (пропілен) і бутени – безбарвні гази. Алкени нормальної будови від С5Н10 до С18Н36 – рідини, а починаючи з С19Н38 – тверді речовини. Алкени мало розчинні у воді, густина їх менша від 1 г/см3. На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено, наявністю в їхніх молекулах подвійного зв`язку. Алкени здатні вступати в реакції приєднання за рахунок розриву π-зв`язку. Крім того, π-зв`язок під дією окислювачів руйнується легше, ніж σ-зв`язок, тому для алкенів характерна участь у ролі відновників в окислювально-відновних реакціях. 1. Гідрування (приєднання водню). Приєднуючи водень, алкени переходять у алкани: СН2=СН2 + Н2® СН3–СН3. Реакції гідрування алкенів відбуваються при наявності каталізаторів (платини, паладію, нікелю). 2. Галогенування (приєднання галогенів). Алкени легко приєднують галогени, особливо хлор і бром: СН2=СН2 + Вr2® СН2Вr–СН2Вr. 1,2-Диброметан На цій реакції базується якісне визначення ненасичених сполук: бромна вода під час пропускання крізь неї етилену та інших алкенів знебарвлюється. 3. Гідрогалогенування (приєднання галогеноводнів). Галогеноводні також легко приєднуються до алкенів, наприклад: СН2=СН2 + НВr ® СН3–СН2Вr. Брометан Ця реакція є гетеролітичною, що відбувається з утворенням іонів в результаті гетеролітичного розриву подвійного зв`язку. Подвійний зв`язок має підвищену електронну густину, тому він легко приєднує електрофільні ("ті, що люблять електрони") частинки. Молекула НВr може відщеплювати іон водню Н+, який виступає як електрофільна частинка. Іон водню взаємодіє з молекулою етилену, при цьому утворюється органічний катіон, який далі реагує з бромід-іонами. Приєднання галогеноводнів до гомологів етилену може відбуватися двома шляхами, наприклад:
1-бромпропан 2-бромпропан Під час цієї реакції утворюється переважно 2-бромпропан. Вивчення подібних реакцій дало змогу російському хіміку В.В.Марковникову сформулювати таке правило: атом водню галогеноводнів та інших несиметричних водневих сполук приєднується до найбільш гідрогенізованого атома вуглецю біля подвійного зв`язку (тобто до атома Карбону, який сполучений з великою кількістю атомів Гідрогену). Правило Марковникова можна пояснити, враховуючи взаємний вплив атомів у молекулах алкенів. Електронегативність Карбону більша, ніж водню, тому на атомі Карбону радикала СН3 (у пропілені) утворюється підвищена електронна густина. У зв`язку з цим група СН3 буде електронодонорною, тобто вона буде подавати електрони (точніше, частину електронної густини). Подача або відтягування електронної густини під дією різних груп називається індуктивним ефектом. Індуктивний ефект характерний для всіх алкільних радикалів. В результаті цього ефекту один атом Карбону біля подвійного зв`язку набуває часткового позитивного заряду, другий – часткового негативного заряду: δ+ δ– СН3®СН=СН2. Стрілкою, напрямленою в бік зміщення електронної густини, позначають індуктивний ефект. Під дією галогеноводню НВr іон водню Н+ приєднуватиметься до атома Карбону з негативним зарядом, а бромід-іон Вr– – до атома Карбону з позитивним зарядом. Тому в наведеній вище реакції переважно утворюється 4. Гідратація (приєднання води). Під час гідратації алкенів при наявності каталізаторів (сірчаної кислоти чи інших) утворюються спирти; приєднання води до гомологів етилену відбувається згідно з правилом Марковникова, наприклад: СН2=СН2 + Н2О ® СН3–СН2ОН; Етиловий спирт СН3–СН=СН2 + Н2О ® СН3–СНОН–СН3. Ізопропіловий спирт 5. Полімеризація. Молекули алкенів можуть сполучатися одна з одною з утворенням макромолекул з розімкненням π-зв`язку. Реакції полімеризації алкенів далі розглянуто детально. 6. Окислення. Алкени легко окислюються, причому залежно від сили окислювачів реакції можуть відбуватися з розривом тільки π-зв`язку або з повним розривом подвійного зв`язку. Перманганат калію в нейтральному і слабколужному середовищах окислює алкени з розімкненням π-зв`язку. Цю реакцію можна зобразити схемою: СН2=СН2 + [О] + Н2О ® СН2ОН–СН2ОН. Етиленгліколь Якщо алкени пропускати крізь водний розчин перманганату калію, то відбуватиметься знебарвлення розчину. Цю реакцію, як і реакцію бромування, використовують для якісного визначення алкенів. Сильні окислювачі (перманганат калію або дихромат калію при наявності сірчаної кислоти) окислюють алкени з розривом молекули за місцем подвійного зв`язку. В результаті утворюються різні кисневмісні органічні сполуки, наприклад:
СН3–СН=СН2 + [О] ––––––––® СН3–СООН + НСООН. Під час високотемпературного окислення алкенів у кисні або на повітрі вони згоряють; СН3=СН2 + 3О2® 2СО2 + 2Н2О. В результаті завжди утворюються оксид Карбону (IV) і вода. Добування. Лабораторним способом добування етилену та його гомологів є дегідратація (відщеплення води) спиртів при наявності концентрованої сірчаної кислоти чи інших водовідбирних агентів. Так, етилен можна добути з етилового спирту при нагріванні його з сірчаною кислотою:
СН3–СН2ОН ––––®СН2=СН2 + Н2О. Алкени можна добути з галогенопохідних алканів дією на них спиртового розчину лугу, наприклад: СН3–СН2Сl + КОН® СН2=СН2 + КСl + Н2О. Хлоретан Відщеплення води та галогеноводнів (гідроген галогенідів) відбувається за правилом Зайцева: атом Гідрогену відщеплюється від сусіднього (до атому Карбону з функціональною групою) менш гідрогенізованого атома Карбону, наприклад:
У промисловості алкени добувають з насичених вуглеводнів під час термічного розкладання (крекінгу) нафти, наприклад: СН2=СН2 + СН4¬ СН3–СН2–СН3® СН3–СН=СН2 + Н2. Етилен Метан Пропан Пропілен
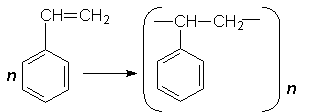
СН3–СН3 –® СН2=СН2 + Н2. Застосування. Етилен та інші алкени є важливою сировиною для хімічної промисловості. З етилену і пропілену виробляють пластмаси – поліетилен і поліпропілен. Етилен є вихідною речовиною для промислового добування багатьох органічних речовин. Алкілуванням алкенів добувають насичені вуглеводні, які використовують як моторне паливо. Етилен прискорює достигання деяких плодів, для чого його вводять в атмосферу сховищ, де знаходяться недостиглі овочі та фрукти. Етилен також запобігає передчасному скиданню плодів рослинами в теплицях. РЕАКЦІЇ ПОЛІМЕРИЗАЦІЇ АЛКЕНІВ Полімеризація. Полімеризація – це процес послідовного сполучення молекул речовини в крупніші молекули. Речовина, що є вихідною в реакції полімеризації, називається мономером, продукт реакції – полімером, або високо-молекулярною сполукою. У реакції полімеризації легко вступають ненасичені сполуки. При полімеризації етилену, наприклад, відбувається розрив π-зв`язків у молекулах під дією світла, випромінювання, хімічних речовин. Утворені частинки взаємодіють одна з одною: СН2=СН2 + СН2=СН2 + СН2=СН2 +··· ® ® –СН2–СН2– + –СН2–СН2– + –СН2–СН2– +··· ® ® –СН2–СН2–СН2–СН2–СН2–СН2–··· . В якийсь момент ріст молекули припиняється. В результаті полімеризації етилену утворюється технічно важливий продукт – поліетилен (–СН2–СН2–)n , де n – ступінь полімеризації. Ступінь полімеризації показує, скільки елементарних ланок (у поліетилені елементарною ланкою є –СН2–СН2–) міститься в молекулі полімеру. Для характеристики полімеру часто використовують поняття "молекулярна маса". В будь-якому зразку полімеру містяться молекули різної довжини і, отже, різної маси. Молекулярною масою полімеру вважають середню відносну молекулярну масу макромолекул цього полімеру. Цю величину можна визначити експериментально. Залежно від таких факторів, як тиск, температура, наявність у системі різних речовин, одна й та сама речовина може полімеризуватися за радикальним і іонним механізмами. Поліетилен. Реакцію полімеризації етилену було відкрито в 1933 р. Властивості поліетилену залежать від молекулярної маси полімеру. Так, полімери з відносною молекулярною масою від 1000 До 10000 – це рідини, масла і воски. Ці полімери мають обмежене застосування. У наш час добувають переважно поліетилен з відносною молекулярною масою 50000 і вище. Такий поліетилен – це тверда біла речовина, тонкі плівки його майже прозорі. Поліетилен практично не розчиняється у воді та інших розчинниках (при кімнатній температурі). Має високу хімічну стійкість: руйнується лише під дією сильних окислювачів. Важлива властивість поліетилену – термопластичність: у нагрітому стані він розм`якшується, при цьому дуже легко можна змінювати його форму; при охолодженні він застигає і зберігає цю форму. Існує два способи промислового добування поліетилену. Поліетилен високого тиску добувають полімеризацією етилену під тиском від 120 до 300 МПа. В таких умовах реакція відбувається за радикальним механізмом. Як ініціатори використовують кисень або органічні пероксиди. При полімеризації під високим тиском відбувається утворення розгалужених молекул поліетилену. Це можливо внаслідок переміщення неспареного електрона по ланцюгу полімеру. Поліетилен низького тиску добувають полімеризацією етилену при наявності каталізаторів під атмосферним або дещо підвищеним (до 5 МПа) тиском. Як каталізатори використовують продукт взаємодії хлориду титану (IV) ТіСl4 з триетилалюмінієм Аl(С2Н5)3 або оксид хрому, нанесений на силікагель. В таких умовах полімеризація відбувається за іонним механізмом: каталізатор сприяє гетеролітичному розриву зв`язку в молекулі етилену. Відносна молекулярна маса поліетилену низького тиску, може досягати трьох мільйонів. Поліетилен низького тиску відрізняється від поліетилену високого тиску меншою розгалуженістю ланцюгів і більшою густиною. Тому часто продукт, добутий при низькому тиску, називають поліетиленом високої густини, а полімер високого тиску – поліетиленом низької густини. Промисловість випускає обидва види поліетилену – високого і низького тиску. Кожен з них має свої, притаманні йому корисні властивості. Так, поліетилен низького тиску більш міцний і твердий, поліетилен високого тиску відрізняється великою еластичністю і морозостійкістю. Поліетилен широко використовується в народному господарстві. З нього виготовляють плівку, труби, електроізоляційні матеріали, тару (бутелі, ящики), покриття, які захищають метали від корозії, волокна і нитки, деталі для машинобудування, предмети побуту. Поліпропілен та інші поліалкени . Полімеризацією пропілену СН3–СН=СН2 добувають інший важливий полімер – поліпропілен:
Поліпропілен – речовина молочно-білого кольору, один з найлегших полімерів, має високу твердість, міцність, стійкість проти стирання, термопластичність. Поліпропілен хімічно стійкий проти дії розчинників, кислот і лугів. Проте порівняно з поліетиленом він менш морозостійкий. Поліпропілен широко використовується для виробницва міцних плівок, труб, електроізоляційних матеріалів, волокон, побутових виробів. Крім поліетилену і поліпропілену в промисловості добувають інші поліалкени, наприклад: полібутен-1 [–СН(С2Н5)–СН2–]n , поліізобутилен [–С(СН3)2–СН2–]n. Співполімеризація. Співполімеризація – це процес утворення полімеру з двох, або більшої кількості різних мономерів. Під час співполімеризації двох мономерів А і В можливе утворення співполімерів різних типів: регулярні співполімери: ··· –А–В–А–В–А–В–А–В– ··· ··· –А–А–А–В–А–А–А–В– ··· нерегулярний співполімер:
Співполімеризація використовується для добування матеріалів з заданими властивостями. Наприклад, здійснюючи співполімеризацію етилену з невеликими кількостями пропілену або бутилену-1, можна добути полімер з підвищеною еластичністю. Співполімер пропілену з невеликою кількістю етилену виявляє більшу морозостійкість, ніж чистий поліпропілен. | ||||||||||||||||||||||||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 103 |
| Текст к ситуации | АЛКІНИ Алкіни – вуглеводні, в молекулах яких є два атоми Карбону, сполучені потрійним зв`язком –СºС–. Алкіни називають також ацетиленовими вуглеводнями. Ацетилен С2Н2 та його гомологічний ряд. Найпростішим алкіном є ацетилен, або етин (за міжнародною номенклатурою):
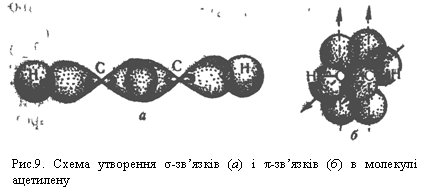
Розглянемо природу зв`язків у молекулі ацетилену згідно з електронною теорією. Під час утворення хімічних зв`язків у молекулі ацетилену гібридизації зазнають тільки дві орбіталі зовнішнього енергетичного рівня атома Карбону: одна s- і одна р-орбіталь. Цей тип гібридизації їазивається sр-гібридизацією. Дві р-орбіталі атома Карбону залишаються в незмінному вигляді. Розміщення двох гібридизованих орбіталей атома Карбону в просторі показано на рис.8: вони напрямлені вздовж однієї осі під кутом 180° одна до одної. Гібридизовані орбіталі атомів Карбону перекривається одна з одною і з
Негібридизовані р-орбіталі атомів розміщені перпендикулярно до лінії σ-зв`язку Карбон – Карбон і перпендикулярно один до одного. Ці р-орбіталі атомів вуглецю взаємодіють одна з одною за рахунок бічного перекривання. Електрони, що перебувають на цих орбіталяк, утворюють два π-зв`язки, напрямлені перпендикулярно один до одного, як показано на рис.9, б. Отже, потрійний зв`язок у молекулі ацетилену складається з одного σ- і двох π-зв`язіків. Потрійний зв`язок міцніший, ніж подвійний, а відстань між атомами Карбону в ацетилені менша, ніж в етилені. Ацетилен С2Н2 — перший член гомологічного ряду. Формули наступних алкінів одержують додаванням до формули ацетилеиу гомологічної різниці СН2: С3Н4, С4Н6 і т. Д. Назви алкінів за міжнародною номенклатурою утворюють з назв алканів з тим самим числом атомів Карбону, замінюючи закінчення -ан на -ін (-ин). Приклади:
Назви алкінів з розгалуженим ланцюгом і структурних ізомерів алкінів, які утворюються внаслідок різного положення потрійного зв`язку в ланцюгу і бічних замісників, будують аналогічно до назв складних алкенів; цифра на початку назви означає найменший номер атома Карбону ланцюга, який знаходиться біля потрійного зв`язку. Приклади:
Загальна формула гомологічного ряду алкінів СnН2n–2, де n = 2, 3, 4, 5… . Властивості. Ацетилен – це безбарвний газ без запаху, температура кипіння –83,8 °С. Розчинний у воді. Технічний ацетилен має неприємний запах, зумовлений наявністю домішок. Як і алкени, ацетилен легко вступає в реакції приєднання і окислення. Крім, того, для алкінів характерні реакції заміщення водню, сполученого з атомом Карбону біля потрійного зв`язку. 1.Гідрування. Алкіни, приєднують водень при наявності каталізаторів з утворенням алканів або алкенів (неповне гідрування). Так, якщо як каталізатор застосовують нікель або платину, то при гідруванні ацетилену утворюється насичена сполука етан, а з каталізатором паладій або залізо – етилен:
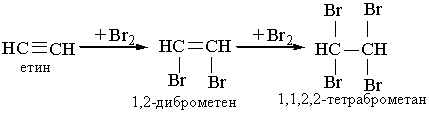
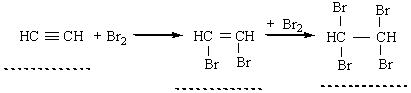
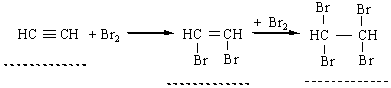
2. Галогенування. Алкіни легко приєднують хлор і бром. Реакція відбувається в дві стадії:
Як і етилен, ацетилен знебарвлює бромну воду. Ця реакція є якісною на ацетилен та інші алкіни. 3. Гідрогалогенування. Процес приєднання галогеноводнів до алкінів відбувається легко в дві розділимі стадії. На першій стадії утворюється галогенопохідна алкену, на другій до цієї похідної приєднується друга молекула галогеноводню згідно з правилом Марковникова:
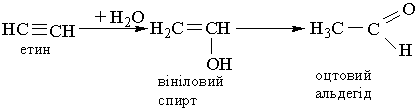
4. Гідратація. Ацетилен та його гомологи гідратуються при наявності каталізаторів – солей Гідраргіруму (II) НgSО4 або Нg(NО3)2. При гідратації ацетилену утворюється оцтовий альдегід:
Взаємодія відбувається через стадію утворення нестійкої сполуки – вінілового спирту, який піддається ізомеризації в стійку сполуку – оцтовий альдегід. Цю реакцію відкрив російський вчений М.Г.Кучеров у 1881 р. Вона лежить в основі промислового добування оцтового альдегіду: 5. Окислення. Алкіни легко окислюються. Так, вони знебарвлюють розчин перманганату калію:
Цю реакцію використовують як якісну на потрійний зв`язок. 6. Реакції заміщення. Гідроген, сполучений, з атомом Карбону біля потрійного зв`язку, дуже рухливий, внаслідок чого для ацетилену та його гомологів характерні реакції заміщення. Наприклад, ацетилен та його гомологи, які містять потрійний зв`язок біля першого атома Карбону, взаємодіють з аміачними розчинами гідроксидів або солей Аргентуму і Купруму (І):
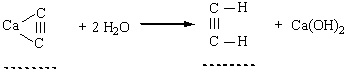
До похідних ацетилену – ацетиленідів металів – належить карбід кальцію СаС2, структура якого містить потрійні зв’язки Карбон – Карбон. Добування. Для добування ацетилену в лабораторних умовах використовують реакцію карбіду кальцію з водою:
У промисловості ацетилен добувають з технічного карбіду кальцію або метану при нагріванні:
Гомологи ацетилену можна добути з дигалогенопохідних алканів, діючи на них спиртовим розчином лугу, наприклад:
Застосування. Ацетилен є вихідною сировиною для багатьох органічних синтезів. У хімічній промисловості його застосовують для добування оцтового альдегіду і оцтової кислоти, вінілхлориду та інших речовин. Ацетилен використовують для автогенного зварювання і різання металів, він згоряє в кисні, виділяючи велику кількість теплоти (температура полум`я досягає 3500 °С). | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 104 |
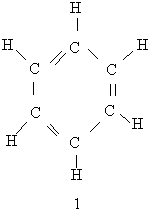
| Текст к ситуации | АРОМАТИЧНІ ВУГЛЕВОДНІАроматичними вуглеводнями називаються сполуки, молекули яких містять стійкі циклічні структури – бензольні ядра. Термін "ароматичні сполуки" виник у початковий період розвитку органічної хімії, коли встановили, що речовини ряду бензолу виділяються з природних ароматичних речовин. БЕНЗОЛ Бензол є найпростішим ароматичним вуглеводнем. Його склад відповідає формулі С6Н6. Будова молекули бензолу. Перша найбільш вдала структурна формула бензолу була запропонована в 1865 р. Німецьким хіміком Кекуле. Згідно з його уявленнями в молекулі бензолу чергуються подвійні і одинарні зв`язки між атомами Карбону, замкненими в шестичленний цикл (див. Формулу 1). Ця формула показує рівноцінність усіх атомів Карбону і Гідрогену, які входять в молекулу бензолу, що було доведено експериментально. Використовуючи формулу 1, слід враховувати, шо бензол не можна відносити до звичайних ненасичених сполук, оскільки він значно відрізняється від них за властивостями, наприклад, не приєднує бром.
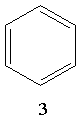
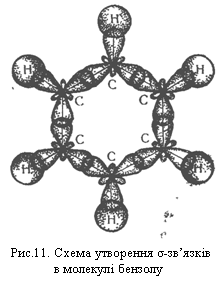
Для позначення бензолу прийнято також формулу 2 і спрощену формулу Кекуле 3. Остання формула використовуватиметься при подальшому викладенні матеріалу: Згідно з сучасними електронними уявленнями будова молекули бензолу пояснюється так. У цій молекулі орбіталі зовнішнього енергетичного рівня кожного атома Карбону перебувають у стані sр2-гібридизації. Електрони, що перебувають на гібридизованих орбіталях, утворюють σ-зв`язки між сусідніми атомами вуглецю і σ-зв`язки Карбон – Гідроген, як показано на рис.11.
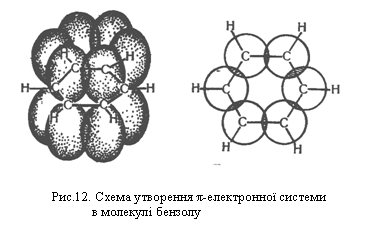
sр2-Гібридизовані орбіталі розміщуються під кутом 120° одна до одної, тому в молекулі бензолу атоми Карбону розміщуються в кутах правильного шестикутника. р-Орбіталі шести атомів Карбону в бензолі, які не беруть участі в гібридизації, розміщуються перпендикулярно до площини бензольного кільця і перекриваються одна з одною зверху і знизу цієї площини. Електрони, що перебувають на цих орбіталях, утворюють єдину стійку π-електронну систему, показану на рис.12. Так виникає хімічний зв`язок, який об`єднує всі шість атомів Карбону в молекулі бензолу.
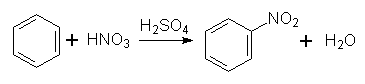
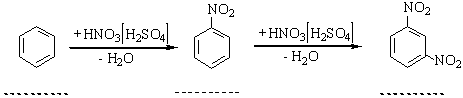
Молекула С6Н6 плоска, всі атоми Карбону розміщені на однакових віддалях один від одного, утворюючи пра вильний шестикутник. Властивості. Бензол – безбарвна рідина, що має характерний запах. Легко переходить у твердий стан: температура плавлення бензолу становить +5,5°С, температура кипіння +80,1°С. У воді бензол практично не розчиняється, але є хорошим розчинником багатьох органічних речовин. Хімічні властивості бензолу та інших ароматичних сполук характеризуються рядом особливостей. Для бензолу характерні реакції заміщення атомів водню в бензольному кільці. Ці реакції відбуваються за механізмом електрофільного заміщення. На відміну від ненасичених сполук типу алкенів і алкінів, бензол дуже стійкий проти окислення, важко вступає в реакції приєднання. Розглянемо найбільш характерні для ароматичних вуглеводнів реакції. 1. Нітрування. При дії на бензол нітруючої суміші (суміш концентрированих азотної і сірчаної кислот) відбуваться заміщення Гідрогену в ядрі бензолу на групу NО2 з утворенням нітробензолу; цей йроцес називається нітруванням:
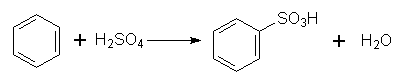
Реакція відбувається за механізмом електрофільного заміщення. Роль електрофільної частинки відіграє іон NО2+, який утворюється в результаті реакції: НNО3 + Н2SО4 ↔ NО2+ + Н2О + НSО4–. 2. Сульфування. Гідроген в бензольному ядрі може бути заміщений на сульфогрупу SО3Н під дією концентрованої сірчаної кислоти з утворенням бензолсульфокислоти; цей процес називається сульфуванням:
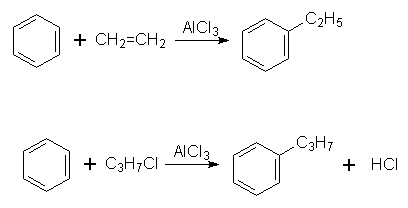
3. Алкілування. В молекулу бензолу замість Гідрогену можна ввести алкільний радикал. Процес алкілування можна здійснити дією на бензол галогенопохідної алкану чи олефіну при наявності каталізатора (алюміній хлорид АlСl3):
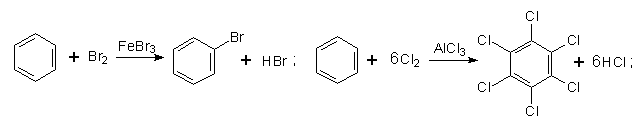
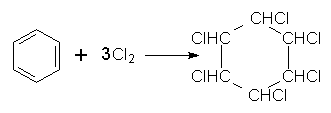
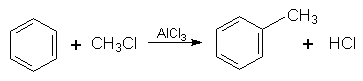
4. Галогенування. Заміщення Гідрогену в бензольному ядрі на Хлор чи Бром здійснюється при взаємодії бензолу з галогенами за участю каталізатора. Реакцію можуть каталізувати FеСl3 (або FеВr3) і АlСl3, при цьому утворюються різні продукти:
Під час інтенсивного опромінення реакційної системи світлом бензол може приєднувати хлор з утворенням гексахлорциклогексану (гексахлорану):
На відміну від наведених вище реакцій галогенування, в яких атом Хлору чи Брому заміщує Гідроген в бензольному ядрі, в цій реакції атоми Хлору приєднуються до всіх атомів Карбону. В результаті руйнується π-електронна система бензолу і утворюється галогенопохідна циклоалкану.
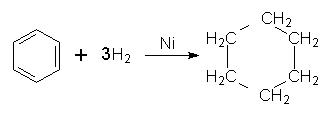
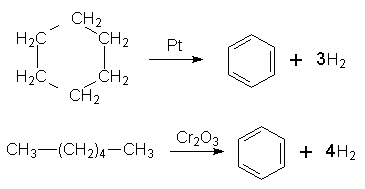
5. Гідрування. Одна з небагатьох реакцій приєднання, в яку може вступати бензол, – реакція гідрування (приєднання атомів Гідрогену) при наявності платинових або нікелевих каталізаторів з утворенням циклогексану: Добування. Бензол виділяють переважно з нафти та кам`яного вугілля при виробництві коксу.
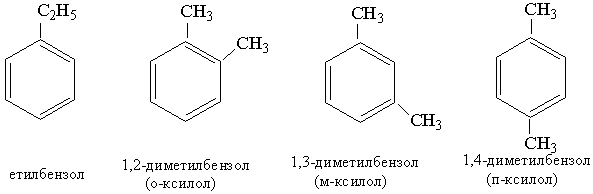
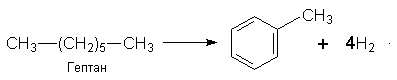
Бензол можна здобути з циклогексану за реакцією дегідрування з участю платини (нікелю) як каталізатора або шляхом циклізації і дегідрування нормального гексану при наявності Сr2О3: Застосування. Бензол є важливою сировиною для органічного синтезу, його використовують при добуванні багатьох інших ароматичних сполук. Бензол застосовують у виробництві барвників, пластмас, пестицидів, вибухових речовин, ліків; його використовують як розчинник лаків, фарб. Бензол входить до складу палива, яке використовується в двигунах внутрішнього згоряння. ГОМОЛОГИ БЕНЗОЛУ Гомологи бензолу – це ароматичні вуглеводні, в бензольному кільці яких один чи декілька атомів Гідрогену заміщені на алкільні радикали. Загальна формула сполук гомологічного ряду бензолу СnН2n–6, де Найпростішим гомологом бензолу, який відрізняється від нього на одну групу СН2, є метилбензол, або толуол, С6Н5–СН3.
Ізомерія та номенклатура. Наступний за толуолом гомолог бензолу має склад С8Н10, якому відповідають чотири сполуки: Як видно з наведених формул, гомологи бензолу, що мають у ядрі два однакових замісники, розрізняються розміщенням цих замісників один відносно одного, тобто є ізомерами. . Назви гомологів бензолу складаються з назви замісника (алкілу) з додаванням кореня бензол, наприклад етилбензол. Якщо гомолог містить кілька замісників, то їхнє положення зазначають цифрами, що означають номери атомів Карбону в бензольному ядрі, біля яких знаходяться ці замісники, наприклад 1,2-диметилбензол. Нумерацію починають з одного з атомів вуглецю, біля якого є замісник. Для багатьох гомологів широко використовуються тривіальні назви (толуол, ксилол), Для позначення ізомерів з двома однаковими замісниками використовують префікси: орто-, мета-, пара-. В орто-ізомері замісники мають положення 1,2, в мета-ізомері – положення 1,3 і в пара-ізомері – положення 1,4. Ароматичні вуглеводні утворюють радикали, які є складовими частинами складніших сполук, наприклад:
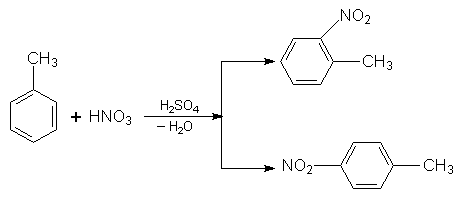
Загальна назва радикалів ароматичних вуглеводнів – арил. Властивості. Найпростіші гомологи бензолу за звичайних умов – це рідини з характерним запахом, вищі гомологи – тверді речовини. Для гомологів бензолу характерні ті самі реакції, що й для самого бензолу. 1. Нітрування, сульфування, та алкілування. Ці реакції відбуваються, як і для бензолу, за механізмом електрофільного заміщення. Особливість перебігу цих реакцій для гомологів бензолу виявляється в тому, що замісник, який є в ядрі, впливає на положення другого замісника. Звичайно при заміщенні Гідрогену в ядрі гомологів бензолу утворюється суміш орто-, мета- і пара-замісників, у якій переважають орто- і пара-сполуки. Наприклад, при нітруванні толуолу реакція йде таким шляхом:
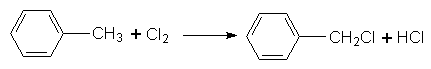
2. Галогенування. Під час галогенування гомологів бензолу з участю каталізаторів утворюються продукти заміщення Гідрогену в бензольному ядрі (реакція відбуваеться так само, як і нітрування). Якщо хлорування здійснюють на світлі, то можуть заміщуватися на Хлор атоми Гідрогену в бічному ланцюгу, наприклад:
Можливе також утворення сполук С6Н5–СНСl2 і С6Н5–ССl3. 2.
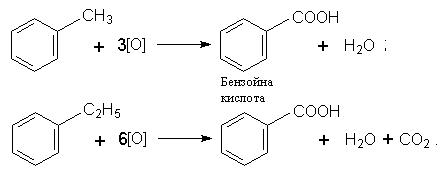
Окислення. Толуол, етилбензол, ксилоли та інші гомологи бензолу окислюються легше, ніж сам бензол. Окислення зазнають бічні замісники, наприклад: 3. Добування. У промислових масштабах гомологи бензолу виділяють переважно з нафти та кам`яного вугілля.
Ці сполуки можна добути синтетичним шляхом, наприклад за реакцією алкілування бензолу: Алкілбензоли можна добути під час циклізації алканів:
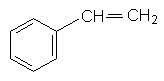
Застосування. Гомологи бензолу використовують у промисловому органічному синтезі. Толуол, наприклад, застосовують для синтезу бензойної кислоти. З пара-ксилолу добувають терефталеву кислоту, яка використовується у виробництві хімічних волокон. Багато гомологів бензолу (толуол, ксилоли) застосовуються як розчинники органічних речовин та полімерів. Стирол. З ароматичних вуглеводнів важливе промислове значення має стирол (вінілбензол). Молекула стиролу містить вініл (радикал етилену), який заміщує атом Гідрогену в бензольному ядрі:
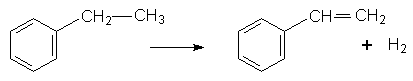
Стирол – рідина з приємним запахом. Температура кипіння 145°С. У воді розчиняється дуже мало. Стирол добувають дегідруванням етилбензолу з участю платинових або нікелевих каталізаторів:
Завдяки наявності подвійного зв`язку в бічному ланцюгу стирол дуже легко полімеризується з утворенням полістиролу: Полістирол – біла тверда речовина. З нього виготовляють електроізоляційні матеріали, різні побутові пластмасові вироби, використовують як декоративний матеріал при обладнанні приладів, машин.
Здійснюючи полімеризацію стиролу в умовах спінення реакційної маси, добувають пінополістирол, або пінопласт. Цей полімер – злегка пориста речовина, є хорошим тепло- і звукоізолятором. Недоліком полістиролу є його мала механічна міцність. Продукт співполімеризації стиролу і бутадієну – удароміцний полістирол. Цей полімер є важливим конструкційним матеріалом, служить замінником металів і деревини.
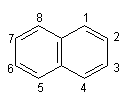
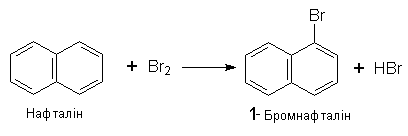
Нафталін. Нафталін – ароматичний вуглеводень складу С10Н8 – двох`-ядерна ароматична система: Така система називається конденсованою. Нафталін – безбарвна кристалічна речовина з температурою плавлення 80,3°С, дуже мало розчинна у воді.
За хімічними властивостями нафталін подібний до бензолу – вступає в реакцію електрофільного заміщення. Йри цьому звичайно замісники займають положення 1, наприклад: Нафталін виділяють з кам`яновугільної смоли або з продуктів переробки нафти. Застосовується у виробництві інших органічних речовин, барвників, ліків, як засіб для боротьби з шкідливими комахами.
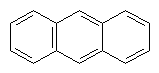
Антрацен. З кам`яновугільної смоли може бути виділений ще один вуглеводень, це конденсована ароматична система – антрацен. Його формула С14Н10, або Антрацен – жовта кристалічна речовина, нерозчинна у воді. За хімічними властивостями подібний до бензолу і нафталіну. Застосовується у виробництві барвників. |
| 1 | Продовжити виконання лабораторної роботи | 2 |
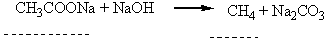




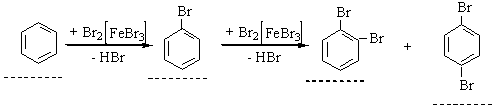
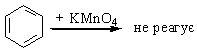
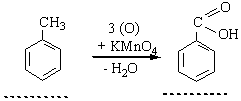
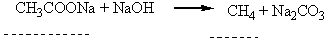




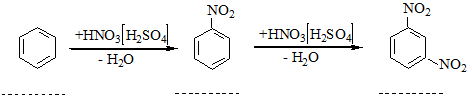
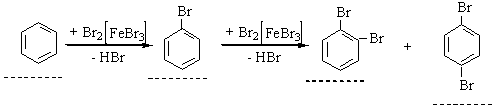
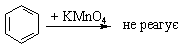
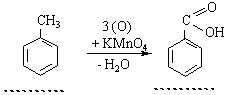
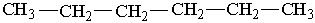
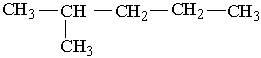
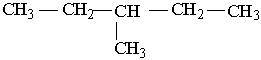
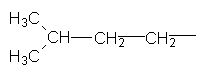
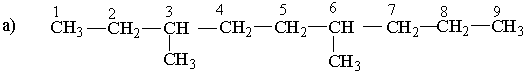
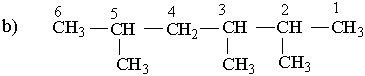
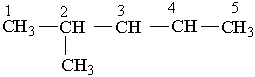
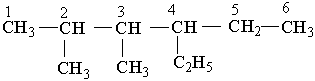
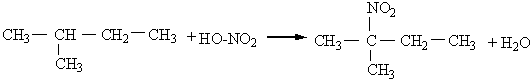
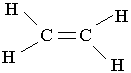 Етилен. Найпростішим алкеном є етилен С2Н4. За міжнародною номенклатурою назва етилену – етен. Структурна формула молекули етилену має такий вигляд:
Етилен. Найпростішим алкеном є етилен С2Н4. За міжнародною номенклатурою назва етилену – етен. Структурна формула молекули етилену має такий вигляд:
 Розглянемо природу зв’язків у молекулі С2Н4 з позицій сучасної електронної теорії. В атомі Карбону, який перебуває в збудженому стані (С* 1s22s12р3), гібридизації можуть зазнавати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві р-орбіталі. Третя р-орбіталь з неспареним електроном залишається в незмінному вигляді.
Розглянемо природу зв’язків у молекулі С2Н4 з позицій сучасної електронної теорії. В атомі Карбону, який перебуває в збудженому стані (С* 1s22s12р3), гібридизації можуть зазнавати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві р-орбіталі. Третя р-орбіталь з неспареним електроном залишається в незмінному вигляді.
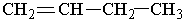
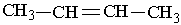
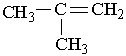
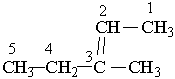 подвійний зв`язок. Отже, алкени в наведених нижче прикладах мають такі назви:
подвійний зв`язок. Отже, алкени в наведених нижче прикладах мають такі назви: