287. Фiзика
2. Визначення відношення питомих теплоємностей газу методом адіабатичного розширення
| • 1 |
| Иллюстрация к шагу | 0287-02-001.mp4 |
| Текст к ситуации | Теоретичні відомості та опис приладу Стан газу можна охарактеризувати трьома величинами - параметрами стану: тиском p, об`ємом V і температурою Т. Рівняння, що пов`язує ці величини, називається рівнянням стану. Рівнянням стану ідеального газу є рівняння Менделєєва-Клапейрона, яке для одного моля газу має вигляд:
де R- універсальна газова стала Величина теплоємності газів залежить від умов нагрівання. З`ясуємо цю залежність, використовуючи рівняння стану (1) і перший закон термодинаміки, який можна сформулювати таким чином: кількість теплоти dQ, переданої системі, витрачається на збільшення її внутрішньої енергії dU і на роботу dA, виконану системою проти зовнішніх сил:
Із рівняння (3) видно, що теплоємність може мати різні значення в залежності від способів нагрівання газу, так як одному і тому ж значенню dТ можуть відповідати різні значення dU і dA. Елементарна робота dA дорівнює:
Розглянемо основні процеси, які відбуваються в ідеальному газі при зміні температури, коли маса газу є незмінною і дорівнює одному молю. Кількість теплоти, необхідна для нагрівання одного моля газу на Ізохорний процес. Процес називається ізохорним, якщо об`єм тіла при зміні температури залишається постійним, тобто V=сonst. Для цього випадку: dV=0. Тому і dA=0, тобто при цьому процесі вся підведена до газу теплота йде на збільшення її внутрішньої енергії. Тоді з рівняння (3) слідує, що молярна теплоємність газу при постійному об`ємі дорівнює:
Ізобарний процес. Процес, що протікає при постійному тиску (p = сonst), називається ізобарним. Для цього випадку формула (3) матиме вигляд:
Із рівняння газового стану (1) одержуємо:
Але p = сonst I dp = 0. Тому
Ізотермічний процес. Ізотермічним процесом називається процес, що протікає при постійній температурі ( T=сonst ). В цьому випадку dT= 0 I dQ = dA, тобто внутрішня енергія газу залишається постійною і вся підведена теплота витрачається на роботу. Робота при ізотермічному процесі визначається за формулою:
Адіабатичний процес. Процес, що протікає без теплообміну з навколишнім середовищем, називається адіабатичним. Першій закон термодинаміки буде мати вигляд (dQ = 0,
Тобто при адіабатичному процесі робота розширення і стиснення робота виконується газом тільки за рахунок зміни запасу внутрішньої енергії. Виведемо рівняння адіабатичного процесу (рівняння Пуассона):
але тоді Розділивши рівняння (6) на (8) і враховуючи (7), одержуємо:
або Інтегруючи і потенціюючи, одержуємо рівняння Пуассона:
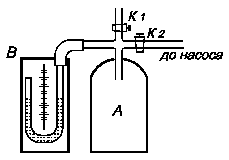
Визначення В балон А, наповнений повітрям при атмосферному тиску p0 = H, нагнітають повітря при закритому крані К1. При нагнітанні повітря в балоні нагрівається. Припинивши накачування, чекають декілька хвилин, поки температура повітря в балоні зрівняється з кімнатною Т1. Це буде перший стан повітря з параметрами Т1, V1 і p1 = Ні + h 1, де h1 – надлишок тиску повітря в балоні над атмосферним тиском Н. h1 визначають як різницю рівнів води в манометрі. Відкривають на короткий час кран К1, щоб тиск в балоні зрівнявся з атмосферним p2 = H (при цьому рівні води в манометрі зрівняються). Зважаючи на малий час розширення і нехтуючи теплообміном між балоном і навколишнім повітрям, вважатимемо процес розширення газу адіабатичним – із першого стану з параметрами p1, V1, Т1 до другого стану з параметрами p2, V2, Т2 (Т2<Т1 ). Закривши кран К1, чекають поки температура повітря в балоні зрівняється з кімнатною. При цьому тиск повітря збільшиться і буде рівним p3 = H + h2. h2 визначають як різницю рівнів води в манометрі після того, як наступить температурна рівновага між балоном і навколишнім повітрям. При такому процесі повітря в балоні із стану з параметрами p2, V2, Т2переходить в третій стан із параметрами V2, T 1, p3 = H + h2. Перехід повітря з 1-го стану в 2-й є адіабатичним і описується рівнянням Пуасона:
Зв’язок параметрів повітря 1-го і 3-го станів описується законом Бойля-Маріотта:
Розв`язуючи рівняння (10) і (11) відносно g, одержуємо:
Розклавши lgp1 I lg p3 в ряд Тейлора і обмежившись двома першими членами, матимемо:
Підставивши ці результати в формулу (12), остаточно матимемо:
Всі розглянуті процеси в балоні віднесено до сталої маси повітря, яке було в балоні до початку дослідів. |
| 1 | Продовжити виконання лабораторної роботи | 2 |
| • 2 |
| Текст к ситуации | ТЕСТ
Щоб перейти до виконання практичної частини Ви повинні засвідчити свої теоретичні знання. Для цього Ви повинні пройти тест. Якщо Ви не впевненні в своїх знаннях, то поверніться до теоретичних відомостей ще раз. Здавши тест у Вас не буде змоги його перездати. Будьте уважні, час на кожну відповідь обмежений (до 60 сек.). |
| 1 | Назад до теорії | 1 |
| 2 | Здати тест | 3 |
| • 3 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №1. Яке рівняння описує адіабатичний процес? |
| 1 | PV = (m / μ)* RT | 4 |
| 2 | P1V1 = P2V2 | 4 |
| 3 | P1V1μ = P2V2μ | 9 |
| 4 | P1 / T1 = P2 / T2 | 4 |
| • 4 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №2. Який процес називається адіабатичним? |
| 1 | при P = const | 5 |
| 2 | при T = const | 5 |
| 3 | при ΔU = 0 | 5 |
| 4 | при Q = 0 | 10 |
| • 5 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №3. Яке з рівнянь термодинаміки відображає адіабатичний процес? |
| 1 | dQ = dU + dA | 11 |
| 2 | dA = dQ - dU | 6 |
| 3 | dA = -dU | 11 |
| 4 | dQ = dA | 6 |
| • 6 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №4. Зв`язок між ізохорною і ізобарною мольними теплоємностями? |
| 1 | Cpm - Cvm = R | 12 |
| 2 | Cpm + Cvm = R | 7 |
| 3 | Cpm / Cvm = R | 7 |
| 4 | Cpm = Cvm | 7 |
| • 7 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №5. Чому дорівнює теплоємність при адіабатичному процесі? |
| 1 | C = 0 | 13 |
| 2 | C = ∞ | 8 |
| 3 | C = Cpm | 8 |
| 4 | C = Cvm | 8 |
| • 8 |
| Текст к ситуации | Увага!!!
Ви не здали тест. Ваші результати: 0 балів . Тест треба перездати вірно відповівши на питання. Уважно прочитайте теоретичні відомості ще раз. Будьте уважні, час на кожну відповідь обмежений (до 60 сек.) . |
| 1 | Продовжити виконання лабораторної роботи | 1 |
| • 9 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №2. Який процес називається адіабатичним? |
| 1 | при P = const | 10 |
| 2 | при T = const | 10 |
| 3 | при ΔU = 0 | 10 |
| 4 | при Q = 0 | 14 |
| • 10 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №3. Яке з рівнянь термодинаміки відображає адіабатичний процес? |
| 1 | dQ = dU + dA | 11 |
| 2 | dA = dQ - dU | 11 |
| 3 | dA = -dU | 15 |
| 4 | dQ = dA | 11 |
| • 11 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №4. Зв`язок між ізохорною і ізобарною мольними теплоємностями? |
| 1 | Cpm - Cvm = R | 16 |
| 2 | Cpm + Cvm = R | 12 |
| 3 | Cpm / Cvm = R | 12 |
| 4 | Cpm = Cvm | 12 |
| • 12 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №5. Чому дорівнює теплоємність при адіабатичному процесі? |
| 1 | C = 0 | 17 |
| 2 | C = ∞ | 13 |
| 3 | C = Cpm | 13 |
| 4 | C = Cvm | 13 |
| • 13 |
| Текст к ситуации | Увага!!!
Ви не здали тест. Ваші результати: 1 бал . Тест треба перездати вірно відповівши на питання. Уважно прочитайте теоретичні відомості ще раз. Будьте уважні, час на кожну відповідь обмежений (до 60 сек.). |
| 1 | Продовжити виконання лабораторної роботи | 1 |
| • 14 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №3. Яке з рівнянь термодинаміки відображає адіабатичний процес? |
| 1 | dQ = dU + dA | 15 |
| 2 | dA = dQ - dU | 15 |
| 3 | dA = -dU | 18 |
| 4 | dQ = dA | 15 |
| • 15 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №4. Зв`язок між ізохорною і ізобарною мольними теплоємностями? |
| 1 | Cpm - Cvm = R | 19 |
| 2 | Cpm + Cvm = R | 16 |
| 3 | Cpm / Cvm = R | 16 |
| 4 | Cpm = Cvm | 16 |
| • 16 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №5. Чому дорівнює теплоємність при адіабатичному процесі? |
| 1 | C = 0 | 20 |
| 2 | C = ∞ | 17 |
| 3 | C = C | 17 |
| • 17 |
| Текст к ситуации | Увага!!!
Ви не здали тест. Ваші результати: 2 бала . Тест треба перездати вірно відповівши на питання. Уважно прочитайте теоретичні відомості ще раз. Будьте уважні, час на кожну відповідь обмежений (до 60 сек.) . |
| 1 | Продовжити виконання лабораторної роботи | 1 |
| • 18 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №4. Зв`язок між ізохорною і ізобарною мольними теплоємностями? |
| 1 | Cpm - Cvm = R | 21 |
| 2 | Cpm + Cvm = R | 19 |
| 3 | Cpm / Cvm = R | 19 |
| 4 | Cpm = Cvm | 19 |
| • 19 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №5. Чому дорівнює теплоємність при адіабатичному процесі? |
| 1 | C = 0 | 22 |
| 2 | C = ∞ | 20 |
| 3 | C = Cpm | 20 |
| 4 | C = Cvm | 20 |
| • 20 |
| Текст к ситуации | Увага!!!
Ви не здали тест. Ваші результати: 3 бала . Тест треба перездати вірно відповівши на питання. Уважно прочитайте теоретичні відомості ще раз. Будьте уважні, час на кожну відповідь обмежений (до 60 сек.) . |
| 1 | Продовжити виконання лабораторної роботи | 1 |
| • 21 |
| Ограничение времени | 1 минут |
| Текст к ситуации | Питання №5. Чому дорівнює теплоємність при адіабатичному процесі? |
| 1 | C = 0 | 23 |
| 2 | C = ∞ | 22 |
| 3 | C = Cpm | 22 |
| 4 | C = Cvm | 22 |
| • 22 |
| Текст к ситуации | ВІТАЄМО!!!
Ви здали тест. Ваш результ добре . Переходьте до виконання практичної частини. |
| 1 | Продовжити виконання лабораторної роботи | 26 |
| • 23 |
| Текст к ситуации | ВІТАЄМО!!!
Ви здали тест. Ваші результати відмінні . Переходьте до виконання практичної частини. |
| 1 | Продовжити виконання лабораторної роботи | 26 |
| • 24 |
| Иллюстрация к шагу | 0287-02-024-00.htm |
| 1 | Продовжити виконання лабораторної роботи | 25 |
| • 25 |
| Текст к ситуации | Вітаємо !!!
Ви вдало виконали лабораторну роботу №2 : "Визначення відношення питомих теплоємностей газу методом адіабатичного розширення". Відішліть звіт викладачу. |
| • 26 |
| Текст к ситуации | Обираємо варіант виконання лабораторної роботи.
Варіант А – відео модулювання, Варіант Б – анімаційне модулювання. |
| 1 | Варіант А | 27 |
| 2 | Варіант Б | 24 |
| • 27 |
| Иллюстрация к шагу | 0287-02-027.mp4 |
| Текст к ситуации | Закриваємо кран К1 якій зєднує балон з атмосферою. |
| 1 | Продовжити виконання лабораторної роботи | 28 |
| • 28 |
| Иллюстрация к шагу | 0287-02-028.mp4 |
| Текст к ситуации | Насосом нагнітаємо повітря у балон. При цьому враховуємо умову, що різниця рівнів в манометрі повинна бути в межі від 60 до 90 мм. |
| 1 | Продовжити виконання лабораторної роботи | 29 |
| • 29 |
| Иллюстрация к шагу | 0287-02-029.mp4 |
| Текст к ситуации | Чекаємо декілька хвилин поки температура в балоні не зрівняється з кімнатною. |
| 1 | Продовжити виконання лабораторної роботи | 30 |
| • 30 |
| Иллюстрация к шагу | 0287-02-030.mp4 |
| Текст к ситуации | Вимірюємо різницю рівнів води у колінах манометра h1. Необхідно записати ці дані у таблицю 1.
|
| 1 | Продовжити виконання лабораторної роботи | 31 |
| • 31 |
| Иллюстрация к шагу | 0287-02-031.mp4 |
| Текст к ситуации | Відкриваємо кран К1 на короткий час, так щоб тиск в балоні зрівнявся з атмосферним тиском . |
| 1 | при цьому рівень води в колінах манометра стає однаковим | 32 |
| 2 | при цьому рівень води в колінах манометра не є однаковим | 31 |
| • 32 |
| Иллюстрация к шагу | 0287-02-032.mp4 |
| Текст к ситуации | Чекаємо поки температура в балоні зрівняеться з температурою в кімнаті. |
| 1 | Чекаємо, поки рівень води в колінах перестає змінюватись | 33 |
| 2 | Поки різниця рівнів води в колінах не досягне 1 см | 32 |
| • 33 |
| Иллюстрация к шагу | 0287-02-033.mp4 |
| Текст к ситуации | Вимірюємо різницю рівнів води у колінах манометра h2. Необхідно записати ці дані у таблицю 1. Щоб зменшити похибку ми повторюємо дослід 5 разів. (Для уніфікації навчального процесу результати 4-х дослідів вже занесені у таблицю 1. Результати проведення лабораторної роботи обраховуються за всіма 5-а дослідами).
|
| 1 | Продовжити виконання лабораторної роботи | 34 |
| • 34 |
| Текст к ситуации | Розраховуємо показник адіабати γ за формулою 1 для всіх пяти дослідів. |
| • 35 |
| Текст к ситуации | Розраховуємо середне значення показника адіабати γ як середне аріфметичне. |
| • 36 |
| Текст к ситуации | Шукаємо абсолютну похибку кожного досліду як різницю γср – γI та заносимо в таблицю 1.
|
| • 37 |
| Текст к ситуации | Знаходимо середню абсолютну похибку експеременту Δγ ср. Заокруглююємо її до однієї значущої цифри та записуємо результат вимірювань у вигляді γ= γ ср +/- Δγ ср. |
| • 38 |
| Текст к ситуации | Останім кроком виконання лаборатоної роботи знаходимо відносну похибку експерименту ε = = (Δγ ср / γ ср )* 100% |
| 1 | Продовжити виконання лабораторної роботи | 25 |
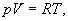 (1)
(1)
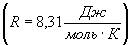 .
.
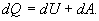 (2)
(2) 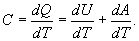 (3)
(3)
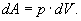
 С, визначається молярною теплоємністю.
С, визначається молярною теплоємністю.
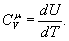 (4)
(4)
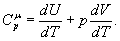 (5)
(5)
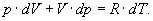 (6)
(6)
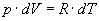 . Підставляючи цей вираз в рівняння (5) і замінюючи dU через
. Підставляючи цей вираз в рівняння (5) і замінюючи dU через 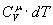 , одержуємо:
, одержуємо:
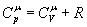 . (7)
. (7)
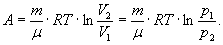
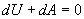 ):
):
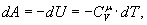
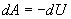 ,
,
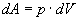 і
і 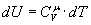 ,
,
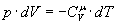 .(8)
.(8)
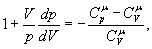
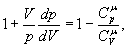
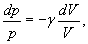 де
де 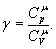
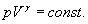 (9)
(9) 
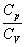 для повітря.Величину
для повітря.Величину 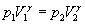 (10)
(10)
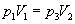 (11)
(11)
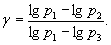 (12)
(12)
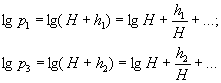
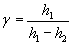 (13)
(13)