Будова і властивості білків
Серед різних органічних сполук у живих організмів білкам належить провідна роль. Ці сполуки переважають у клітинах і кількісно. Так, у клітинах тварин вони становлять від 40 % до 50 % сухої речовини, а рослин – від 20 % до 35 %. До складу молекул білків входять атоми Карбону, Оксигену, Нітрогену, Гідрогену, Сульфуру, а також Фосфору, Феруму та ін.
Білки – це високомолекулярні біополімери, мономерами яких є залишки амінокислот (мал.1). Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків лише 20 амінокислот (кількість можливих варіантів у цьому випадку становить приблизно 2 ∙ 1018). Кожен білок характеризується постійним складом амінокислотних залишків та їхньою певною послідовністю.
Усі амінокислоти мають спільну групу атомів. Вона складається з аміногрупи (–NH2), якій притаманні лужні властивості, та карбоксильної групи (–СООН) з кислотними властивостями. Ці групи, як і атом Гідрогену, зв’язані з одним і тим самим атомом Карбону. Групи атомів, за якими амінокислоти розрізняються між собою, називають радикалами, або R–групами.
Двадцять амінокислот, залишки яких входять до складу білків, називають основними.
Існують різні класифікації амінокислот. Зокрема, їх поділяють на замінні та незамінні. Замінні амінокислоти можуть синтезуватись в організмі людини і тварин з продуктів обміну речовин. Натомість незамінні амінокислоти в організмі людини і тварин не синтезуються. Вони надходять разом з їжею. Їх синтезують рослини, гриби, бактерії.
Білки, які містять усі незамінні амінокислоти, називають повноцінними, на відміну від неповноцінних, до складу яких не входять ті чи інші незамінні амінокислоти.
Амінокислотні залишки у молекулі білка сполучаються між собою міцним ковалентним зв’язком, який виникає між карбоксильною групою однієї амінокислоти і аміногрупою іншої.

Мал.1 – Схема будови поліпептидного ланцюга
NH2—CH—COOH
|
R
Загальна формула амінокислоти
Такий тип зв’язку називають пептидним (від грец. Пептос — зварений). Структури, які складаються з великої кількості амінокислотних залишків, належать до поліпептидів:
…NH2—CH—CO—NH—CH—CO—NH—CH—COOH…
I I I
R1 R2 R3
Поліпептиди з високою молекулярною масою (понад 6000) називають білками. Вони складаються з одного або кількох поліпептидних ланцюгів, які можуть містити до кількох тисяч амінокислотних залишків.
Відомо чотири рівні структурної організації білків: первинний, вторинний, третинний і четвертинний (мал.2).
Первинна структура білків визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю.
Часто молекула білка у вигляді ланцюга, складеного з амінокислотних залишків, нездатна виконувати специфічні функції. Для цього вона має набути складнішої просторової структури.
O H
|| |
—C—N—
Схема пептидного зв’язку
Вторинна структура характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль. Радикали амінокислот (R–групи) при цьому залишаються ззовні спіралі. У підтриманні вторинної структури важлива роль належить водневим зв’язкам, які виникають між атомами Гідрогену NH2–груп одного витка спіралі та Оксигену СО–групи іншого.
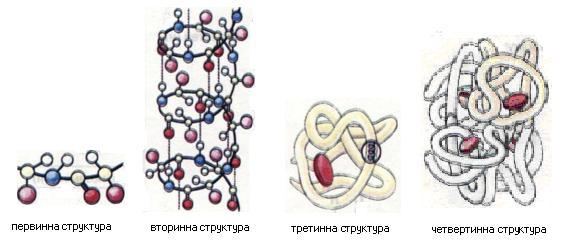
Мал.2 – Просторові моделі структурної організації білків
Третинна структура зумовлена здатністю поліпептидної спіралі закручуватись певним чином у грудку, або глобулу (від лат. Глобулюс – кулька). Важлива роль у підтриманні третинної структури належить так званим дисульфідним зв’язкам, які виникають між залишками амінокислоти цистеїну.
Четвертинна структура білків виникає внаслідок об’єднання окремих глобул, які разом утворюють функціональну одиницю. Стабілізація четвертинної структури досягається гідрофобними, електростатичними та іншими взаємодіями, а також водневими зв’язками.
Залежно від конфігурації білки можуть бути фібрилярними та глобулярними. Молекули фібрилярних білків складаються з видовжених, паралельно розташованих поліпептидних ланцюгів. Як правило, ці білки нерозчинні у воді й виконують в організмі структурну функцію (наприклад, кератин входить до складу волосся людини або шерсті тварин). Молекули глобулярних білків складаються зі щільно скручених поліпептидних ланцюгів і за формою нагадують кульку. Ці білки здебільшого розчинні у воді та сольових розчинах. Вони виконують в організмі різноманітні функції (наприклад, гемоглобін забезпечує транспорт газів, пепсин – розщеплення білків їжі).
Залежно від особливостей будови білки поділяють на прості та складні. Прості, або протеїни (від грец. Протос — перший), складаються лише з амінокислотних залишків, а складні, або протеїди (від грец. Протос та ейдос – вигляд), у своєму складі мають також залишки фосфатної та нуклеїнових кислот, вуглеводів, ліпідів, атоми Феруму, Цинку, Купруму та ін.
Функціональні властивості білків, крім їхнього амінокислотного складу, зумовлені також і послідовністю амінокислотних залишків у поліпептидному ланцюзі та його просторовою структурою.
Одна з основних властивостей білків — це їхня здатність під впливом різних факторів (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням поліпептидного ланцюга без зміни його первинної структури, називають денатурацією (від лат. Де – префікс, який означає втрату, і натура – природні властивості) (мал. 3). Як правило, денатурація має необоротний характер. Проте на початкових стадіях денатурації за умови припинення дії факторів, що спричиняють цей процес, білок може відновити свій початковий стан. Це явище має назву ренатурації (від лат. Ре – префікс, який означає поновлення). У живих організмів відбувається часткова оборотна денатурація білків, пов’язана з виконанням ними певних функцій – забезпеченням рухової активності, передачею в клітини сигналів з довкілля, прискорення біохімічних реакцій тощо.
Процес порушення первинної структури білків називають деструкцією (від лат. Деструкціо – руйнування). Він завжди має необоротний характер.
Залежно від розчинності або нерозчинності у воді білки поділяють на гідрофільні та гідрофобні. Серед білків є активні у хімічному відношенні (наприклад, ферменти) і малоактивні. Деякі білки стійкі до дії різних факторів (наприклад, температури, хімічних чинників), інші – нестійкі. Наприклад, кератин, який входить до складу волосся, кігтів, нігтів, копит, здатний витримувати високу й низьку температуру. Натомість білок яйця птахів (овальбумін) при нагріванні змінює свою структуру.
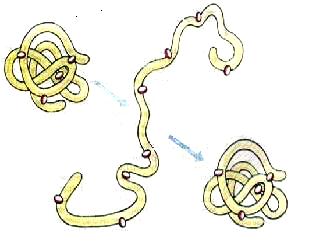
Мал.3 – Денатурація та ренатурація білка
Ферменти та їх властивості
Природа ферментів та особливості ферментативного каталізу
Ферменти – потужні біологічні каталізатори, які прискорюють протікання самих різноманітних хімічних процесів.
Ферменти, або ензими, складають самий крупний та найбільш організований клас білкових молекул. Ферменти синтезуються самою клітиною та виконують в ній функції каталізаторів біохімічних реакцій.
Каталізаторами називають речовини, які приймають участь у реакції, змінюючи її швидкість, але самі в кінці реакції залишаються хімічнонезмінними.
Хімічна взаємодія молекул відбуваються лише в результаті їх зіткнення при умові, що в цей момент вони володіють деяким надлишком вільної енергії, достатнім для переходу їх в активований (перехідний) стан. Швидкість реакції пропорційна концентрації активованих молекул. Сутність дії каталізатора в тому, що він зв’язуючи реагуючі речовини приводить до появи нового перехідного стану, для якого вільна енергія активації набагато нижча, ніж в некаталізуємій реакції. Слід відмітити, що введення каталізатора не позначається на сумарному енергетичному ефекті реакцій ∆G і не змінює стан рівноваги в реагуючій системі.
Каталіз називають гомогенним, якщо каталізатор та реагуюча речовина знаходиться в одній фазі, і гетерогенним, якщо вони утворюють дві фази.
Ферментативний каталіз має ряд суттєвих відмінностей від хімічного. Перш за все, ферментативний каталіз протікає в живій клітині в обмеженому діапазоні температур, значень рН та тиску. В більшості випадків умови, в яких ферменти здійснюють каталіз є достатньо “м’які”.
Одна з найважливіших особливостей ферментів як каталізаторів – строга специфічність їх дії. Під специфічністю розуміють властивість ферменту реагувати:
- лише з однією речовиною (абсолютна специфічність),
- з групою речовин, які мають загальні структурні ознаки (групова специфічність);
- діють на певний хімічний зв’язок (відносна специфічність),
- діють на певний стереоізомер (стереохімічна специфічність).
Деякі ферменти утворюють в клітині так звані мультиферментні системи, які відрізняються за складністю молекулярної організації. Прогрес перетворення речовин за участі системи ферментів являє собою серію послідовних реакцій, кожну з яких каталізує певний фермент. При цьому продукт першої реакції слугує субстратом для другої, продукт другої реакції слугує субстратом для третьої, і т. д. Перетворення субстрату S в продукт Р в простій мультиферментній системі (Е1 – Еn) іде за схемою:
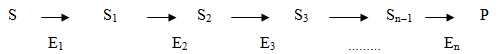
Така кооперативність та строга послідовність в дії ферментів визначають їх саму суттєву відмінність від каталізаторів іншої природи.
Кожна клітина має регуляторні механізми, які дозволяють їй в залежності від потреб змінювати швидкість окремих біохімічних реакцій в результаті регуляції синтезу певних ферментів або їх активності. Здатність підкорюватись такій регуляції – важлива особливість ферментів як каталізаторів.
Каталітична активність ферментів надзвичайно висока. Хімічна реакція розкладання пероксиду водню каталізується іонами заліза. В живій клітині під впливом ферменту каталази, який містить залізо, ця реакція протікає в 1010 раз швидше, ніж з неорганічним каталізатором.
Структура, механізм дії та властивості ферментів
Ферменти поділяються на: одно– та двокомпонентні. Однокомпонентні – прості білки, двокомпонентні – складні.
Каталітична активність однокомпонентних ферментів обумовлена певним просторовим розташуванням залишків амінокислот на окремих ділянках молекули фермента – активних центрах. Саме на них і протікають каталітичні реакції. Активні центри реагують лише з тим субстратом, просторова конфігурація якого співпадає із структурою активного центру.
Більшість ферментів належить до двокомпонентних. Їх молекула складається з білкової частини – апофермента та небілкового компонента кофактора. В залежності від міцності зв’язку з апоферментом кофактор називають простетичною групою, якщо він міцно зв’язаний з білком, або коферментом, якщо цей зв’язок слабкий. Каталітичною активністю володіє лише кофактор, роль якого часто виконують складні органічні комплекси, наприклад деякі вітаміни. Апофермент посилює каталітичну активність кофакторів та визначає спеціальність дії ферментів. Один і той же кофактор, зв’язуючись з різними білками, може каталізувати певну реакцію, наприклад, відщеплення водню, з десятками різних субстратів.
Ферментивна реакція проходить через ряд послідовних стадій. В початковий момент фермент Е утворює з молекулою субстрату S проміжну сполуку – фермент субстратний комплекс ES0. На слідуючих стадіях фермент активує субстрат, тобто змінює його таким чином, що субстрат може вступати у відповідну хімічну реакцію. Цьому моменту відповідає утворення каталітично активного комплексу ES′0. Далі відбувається реакція на молекулі ферменту, в результаті якої утворюється фермент–продуктний комплекс ЕР. Процес закінчується виділенням продукту реакції Р та регенерацією ферменту Е.
Білкова природа ферментів обумовлює їх лабільність, яка виражається в тому, що ферменти втрачають активність під впливом деяких факторів. Найважливіший з них – температура та реакція середовища. Залежність активності ферментів від температури має складний характер. Із підняттям температури активність піднімається, але в досить вузьких межах. Максимальна активність досягається в області максимальної температури, після чого починається падіння активності, пов’язане з денатурацією білкової частини ферменту при підвищених температурах і втратою в результаті цього каталітичної активності. Оптимальна температура, як і температура, що викликає інактивацію, для різних ферментів різна. Одні ферменти починають втрачати активність вже при 40 0С, інші – лише при 70 0С. Майже всі ферменти незворотньо руйнуються при 80 0С.
Більшість ферментів має максимальну активність в нейтральному середовищі, але для деяких оптимум рН може знаходитись в кислій або лужній областях значень.
Для кожного ферменту характер залежності активності від рН визначається ступенем впливу концентрації водневих та гідроксильних іонів на іонізацію функціональних груп ферменту та субстрату і структуру ферменту.
Активність ферменту залежить і від присутності у середовищі деяких хімічних сполук. Одні підвищують активність ферментів і називаються активаторами, другі – понижують – інгібітори. Розрізняють оборотне та необоротне інгібування. При необоротному інгібуванні фермент повністю або частково втрачає активність в результаті необоротного розкладання або модифікації його функціональних груп.
Оборотне інгібування може бути конкурентним і неконкурентним. В першому випадку (конкурентне інгібування) по структурі молекули нагадують субстрат і можуть взаємодіяти з активним центром ферменту, тобто конкурувати за нього з субстратом. При цьому ступінь інгібування залежить від співвідношення концентрацій субстрату та інгібітора, і тому дія інгібітора може бути знижена або усунена підвищенням концентрації субстрату. Класичним прикладом конкурентного інгібування є конкуренція між янтарною (субстрат) та малоновою (інгібітор) кислотами, між n–амінобензойною кислотою (субстрат) та стрептоцидом (інгібітор).
В основі інгібування лежить здатність інгібітора взаємодіяти з будь-якою групою молекули ферменту, яка суттєво впливає на його активність, але яка не входить в активний центр.
Також можливе гальмування ферментативної реакції, яке спостерігається при надлишковій концентрації субстрату (субстратне інгібування). В цему випадку в результаті реакції ферменту одночасно з двома молекулами субстрату утворюється неактивний фермент-субстратний комплекс.
Інгібування кінцевим продуктом здійснюється регуляторним механізмом клітини по типу оборотного зв’язку і заключається у подавленні синтезу ферментів, що каталізують реакцію, продуктом, який опиняється в клітині в надлишку.
Кожному виду мікроорганізмів властивий певний набір ферментів, які постійно присутні в клітині (конститутивні ферменти). В той же час деякі ферменти синтезуються клітиною лише тоді, коли в середовищі з’являється відповідний субстрат. Такі ферменти називаються індуктивними. По місту дії ферменти поділяються на внутріклітинні (ендоферменти) та ферменти, які клітина виділяє у навколишнє середовище (екзоферменти). Екзоферменти необхідні більшості прокаріот.
Класифікація ферментів
В період відкриття перших ферментів назви їм давали по випадковим ознакам. Наприклад, пепсин, знайдений в шлунковому соці, отримав свою назву від грецького слова “пепсис” – травлення. Пізніше Дюкло запропонував ввести раціональну номенклатуру, де ферменти називались по субстрату, на який вони діють, із додаванням суфікса “аза”. Так, фермент, який розкладає сахарозу, називається сахараза, фермент, який розкладає сечовину (urea) – уреаза і т. Д. Однак така класифікація виявилась неоднозначною, так як різні реакції з одним і тим же субстратом можуть каталізувати різні ферменти. В даний момент відомо біля 1000 ферментів.
Кожний фермент має чотирьохзначний шифр з номерами класу, підкласу, підпідкласу, остання цифра відповідає номеру ферменту у відповідному підпідкласі. Систематична назва ферменту несе хімічну інформацію. Частіше застосовують тривіальні назви ферментів. Розглянемо характеристику класів.
1.Оксидоредуктази – прискорюють окисно–відновні реакції, здійснюючи перенос електронів або атомів водню (е+ Н+) від субстрату, що окислюється (донора електрона) до акцептора, який при цьому відновлюється. В процесі переносу від субстрату до кінцевого акцептора приймають участь 4 головні групи оксидоредуктаз: первинні дегідрогенази, вторинні дегідрогенази, цитохроми, хінони. Біологічне окислення органічних речовин в клітині – процес багатостадійний, в якому приймає участь комплекс ферментів.
2.Трансферази – каталізують перенос функціональних груп.
Ферменти цього класу поділяються в залежності від характеру групи, що переноситься. До трансфераз відносяться трансферази, які каталізують перенос залишка фосфорної кислоти. Завдяки цій реакції в клітині цілий ряд органічних сполук перетворюється в фосфорні ефіри з підвищеною хімічною активністю і тому легко вступають у наступні реакції.
3 Гідролази – каталізують реакції гідролітичного розщеплення складних органічних субстратів. В залежності від хімічної природи звязку, на яку діють гідролазим, розрізняють естерази – здійснюють гідроліз складних ефірів, глікозидази – діють на глікозидні звязки вуглеводнів, пептидази – каталізують гідроліз білків по пептидним зв’язкам. В прокаріот більшість гідролаз належать до позаклітинних ферментів.
4 Ліази – каталізують негідролітичні відщеплення атомних угруповань з утворенням подвійних зв’язків або приєднання по місту цих зв’язків. Діють на зв’язки типу С = С, С = N, С = О
5 Ізомерази – каталізують внутрішньомолекулярні перетворення, наприклад перетворення одного ізомера в інший.
6 Лігази (систетази ) каталізують синтез складних органічних сполук. |